
理论要点: 有效碰撞:能发生反应的碰撞 活化分子:具有较大的动能并且能发生有效碰撞的分子 活化能:活化分子所具有的最低能量与反应物分子的平均 能量之差 其他条件相同时,活化能越低的化学反应,反应速率越高
理论要点: 有效碰撞:能发生反应的碰撞 活化分子:具有较大的动能并且能发生有效碰撞的分子 活化能:活化分子所具有的最低能量与反应物分子的平均 能量之差 其他条件相同时,活化能越低的化学反应,反应速率越高
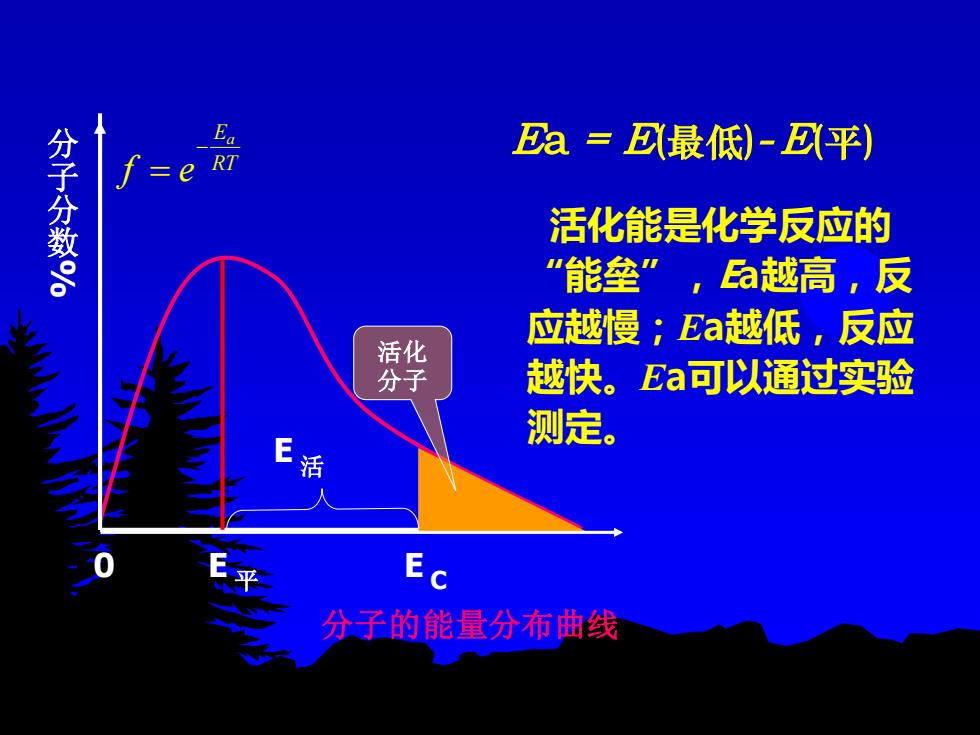
Ea=D最低)-D平) 分子分数S e 活化能是化学反应的 “能垒”,越高,反 应越慢;Ea越低,反应 活化 分子 越快。Ea可以通过实验 测定。 分子的能量分布曲线
Ea = E(最低)- E(平) 活化能是化学反应的 “能垒” ,Ea越高,反 应越慢;Ea越低,反应 越快。Ea可以通过实验 测定。 平 E C E 活 E 分 子 分 数 % 分子的能量分布曲线 0 Ea RT f e − = 活化 分子

一 般化学反应的活化能约在40w400k.mo1之间 多数化学反应的活化能约在60w250k.mo1之间 反应的活化能小于40k灯mol1时,反应速度很快 反应的活化能大于400k.mol1时,反应速度很慢 中和化学反应的活化能约在13~25k.mo1之间
一般化学反应的活化能约在40~400 kj.mol-1之间 多数化学反应的活化能约在60~250 kj.mol-1之间 反应的活化能小于 40 kj.mol-1时,反应速度很快 反应的活化能大于 400 kj.mol-1时,反应速度很慢 中和化学反应的活化能约在13~25 kj.mol-1之间

2) 过渡状态理论 ■ 化学反应并不是通过反应物分子的简单碰 撞完成的,在反应物到产物的转变过程中, 先形成一种过渡状态,即反应物分子活化形 成配合物的中间状态。 如A+ BC ABC
(2)过渡状态理论 化学反应并不是通过反应物分子的简单 碰 撞完成的,在反应物到产物的转变过程中, 先形成一种过渡状态,即反应物分子活化形 成配合物的中间状态。 如 A + BC ABC

2.3 影响化学反应速率的主要因素 内因:反应的活化能 外因:浓度、温度、催化剂 浓度或分压对反应速率的影响 1。(基)元反应:对于简单反应,反应物分子在有效碰撞中 经炎过一次化学变化就能转化为产物的反应。 .一(基)元反应的化学反应速率方程式:可由质量作用定律 描述
内因:反应的活化能 外因:浓度、温度、催化剂 一、浓度或分压对反应速率的影响 1.(基)元反应:对于简单反应,反应物分子在有效碰撞中 经过一次化学变化就能转化为产物的反应。 2.(基)元反应的化学反应速率方程式:可由质量作用定律 描述。 2.3 影响化学反应速率的主要因素