
第三章原子结构和元素周期表 3.1原子核外电子的运动状态 一、玻尔的原子结构理论 1913年,丹麦青年物理学家玻尔(N.Bohhr)在氢原子光谱和普朗克(M.Planck)量子 理论的基础上提出了如下假设: ()原子中的电子只能沿着某些特定的、以原子核为中心、半径和能量都确定的轨 道上运动,这些轨道的能量状态不随时间而改变,称为稳定轨道(或定态轨道)。 (2)在一定轨道中运动的电子具有一定的能量,处在稳定轨道中运动的电子,既不 吸收能量,也不发射能量。电子只有从一个轨道跃迁到另一轨道时,才有能量的吸收和 放出。在离核越近的轨道中,电子被原子核束缚越牢,其能量越低;在离核越远的轨道 上,其能量越高。轨道的这些不同的能量状态,称为能级。轨道不同,能级也不同。在 正常状态下,电子尽可能处于离核较近、能量较低的轨道上运动,这时原子所处的状态 称为基态,其余的称为激发态。 (③)电子从一个定态轨道跳到另一个定态轨道,在这过程中放出或吸收能量,其频 率与两个定态轨道之间的能量差有关。 二、电子的波粒二象性 光的干涉、衍射等现象说明光具有波动性:而光电效应、光的发射、吸收又说明光 具有粒子性。因此光具有波动和粒子两重性,称为光的波粒二象性。 光的波粒二象性启发了法国物理学家德布罗意(de Brog1ie),1924年,他提出了一 个大胆的假设:认为微观粒子都具有波粒二象性:也就是说,微观微粒除具有粒子性外, 还具有波的性质,这种波称为德布罗意波或物质波。1927年,德布罗意的假设经电子衍 射实验得到了完全证实。美国物理学家戴维逊(C.J.Davisson)和革末(L.H.Ge rmer)进 行了电子衍射实验,当将一束高速电子流通过镍晶体(作为光橱)而射到荧光屏上时,结 果得到了和光衍射现象相似的一系列明暗交替的衍射环纹,这种现象称为电子衍射。衍 射是一切波动的共同特征,由此充分证明了高速运动的电子流,也具有波粒二象性。除 光子、电子外,其他微观粒子如:质子、中子等也具有波粒二象性。 这种具有波粒二象性的微观粒子,其运动状态和宏观物体的运动状态不同。例如, 导弹、人造卫星等的运动,它在任何瞬间,人们都能根据经典力学理论,准确地同时测 定它的位置和动量:也能精确地预测出它的运行轨道。但是像电子这类微观粒子的运动
1 第三章 原子结构和元素周期表 3.1 原子核外电子的运动状态 一、玻尔的原子结构理论 1913 年,丹麦青年物理学家玻尔(N.Bohhr)在氢原子光谱和普朗克(M.Planck)量子 理论的基础上提出了如下假设: (1)原子中的电子只能沿着某些特定的、以原子核为中心、半径和能量都确定的轨 道上运动,这些轨道的能量状态不随时间而改变,称为稳定轨道(或定态轨道)。 (2)在一定轨道中运动的电子具有一定的能量,处在稳定轨道中运动的电子,既不 吸收能量,也不发射能量。电子只有从一个轨道跃迁到另一轨道时,才有能量的吸收和 放出。在离核越近的轨道中,电子被原子核束缚越牢,其能量越低;在离核越远的轨道 上,其能量越高。轨道的这些不同的能量状态,称为能级。轨道不同,能级也不同。在 正常状态下,电子尽可能处于离核较近、能量较低的轨道上运动,这时原子所处的状态 称为基态,其余的称为激发态。 (3)电子从一个定态轨道跳到另一个定态轨道,在这过程中放出或吸收能量,其频 率与两个定态轨道之间的能量差有关。 二、电子的波粒二象性 光的干涉、衍射等现象说明光具有波动性;而光电效应、光的发射、吸收又说明光 具有粒子性。因此光具有波动和粒子两重性,称为光的波粒二象性。 光的波粒二象性启发了法国物理学家德布罗意(de Broglie),1924 年,他提出了一 个大胆的假设:认为微观粒子都具有波粒二象性;也就是说,微观微粒除具有粒子性外, 还具有波的性质,这种波称为德布罗意波或物质波。1927 年,德布罗意的假设经电子衍 射实验得到了完全证实。美国物理学家戴维逊(C.J.Davisson)和革末(L.H.Ge rmer) 进 行了电子衍射实验,当将一束高速电子流通过镍晶体(作为光栅)而射到荧光屏上时,结 果得到了和光衍射现象相似的一系列明暗交替的衍射环纹,这种现象称为电子衍射。衍 射是一切波动的共同特征,由此充分证明了高速运动的电子流,也具有波粒二象性。除 光子、电子外,其他微观粒子如:质子、中子等也具有波粒二象性。 这种具有波粒二象性的微观粒子,其运动状态和宏观物体的运动状态不同。例如, 导弹、人造卫星等的运动,它在任何瞬间,人们都能根据经典力学理论,准确地同时测 定它的位置和动量;也能精确地预测出它的运行轨道。但是像电子这类微观粒子的运动

由于兼具有波动性,人们在任何瞬间都不能准确地同时测定电子的位置和动量:它也没 有确定的运动轨道。所以在研究原子核外电子的运动状态时,必须完全摒弃经典力学理 论,而代之以描述微观粒子运动的量子力学理论。 三、波函数与原子轨道 l926年奥地利物理学家薛定谔(伦.Schrodinger)把电子运动帮光的波动性理论联系 起来,提出了描述核外电子运动状态的数学方程,称为薛定谔方程。薛定谔方程把作为 粒子物质特征的电子质量(m)、位能(W)和系统的总能量(E)与其运动状态的波函数0列 在一个数学方程式中,即体现了波动性和粒子性的结合。解薛定谔方程的目的就是求出 波函数以及与其相对应的能量E,这样就可了解电子运动的状态和能量的高低。求得 (x,y,z)的具体函数形式,即为方程的解。它是一个包含三个常数项、1、m和三个变 量x、y、z的函数式。 从理论上讲,通过解薛定谔方程可得出波函数,但薛定谔方程的许多解在数学上是 合理的,且运算极为复杂,只有满足特定条件的解才有物理意义,用来描述核外电子运 动状态。为了得到描述电子运动状态的合理解,必须对三个参数、1、m按一定的规律 取值。这三个函数,分别称为主量子数、角量子数和磁量子数 求解方程得出的不是一个具体数值,而是用空间坐标(x,y,z)来描述波函数的数学 函数式,一个波函数就表示原子核外电子的一种运动状态并对应一定的能量值,所以波 函数也称原子轨道。但这里所说的原子轨道和宏观物体固定轨道的含义不同,它只是反 映了核外电子运动状态表现出的波动性和统计性规律。 为了方便,解方程时一般先将空间坐标(x,y,z)转换成球坐标平(:,日,中),而后把0 分解为用r表示的径向分布函数R()和仅包含角度变量和的角度分布函数YO。R为电 子与原子核间的距离,和代表角度。由于的角度分布与主量子数1无关,且1相同时 其角度分布图总是一样的。在下章讨论成键问题时,角度分布图有直接应用,故比较重 要。图3-1为某些原子轨道的角度分布图,图中的“+”、“-”号表示波函数的正、负值
2 由于兼具有波动性,人们在任何瞬间都不能准确地同时测定电子的位置和动量;它也没 有确定的运动轨道。所以在研究原子核外电子的运动状态时,必须完全摒弃经典力学理 论,而代之以描述微观粒子运动的量子力学理论。 三、波函数与原子轨道 1926 年奥地利物理学家薛定谔(E.Schrödinger)把电子运动帮光的波动性理论联系 起来,提出了描述核外电子运动状态的数学方程,称为薛定谔方程。薛定谔方程把作为 粒子物质特征的电子质量(m)、位能(V)和系统的总能量(E)与其运动状态的波函数()列 在一个数学方程式中,即体现了波动性和粒子性的结合。解薛定谔方程的目的就是求出 波函数以及与其相对应的能量 E,这样就可了解电子运动的状态和能量的高低。求得 (x,y,z)的具体函数形式,即为方程的解。它是一个包含三个常数项 n、l、m 和三个变 量 x、y、z 的函数式。 从理论上讲,通过解薛定谔方程可得出波函数,但薛定谔方程的许多解在数学上是 合理的,且运算极为复杂,只有满足特定条件的解才有物理意义,用来描述核外电子运 动状态。为了得到描述电子运动状态的合理解,必须对三个参数 n、l、m 按一定的规律 取值。这三个函数,分别称为主量子数、角量子数和磁量子数。 求解方程得出的不是一个具体数值,而是用空间坐标(x,y,z)来描述波函数的数学 函数式,一个波函数就表示原子核外电子的一种运动状态并对应一定的能量值,所以波 函数也称原子轨道。但这里所说的原子轨道和宏观物体固定轨道的含义不同,它只是反 映了核外电子运动状态表现出的波动性和统计性规律。 为了方便,解方程时一般先将空间坐标 (x,y,z)转换成球坐标 (r,, ),而后把() 分解为用 r 表示的径向分布函数 R(r)和仅包含角度变量和的角度分布函数 Y()。R 为电 子与原子核间的距离,和代表角度。由于的角度分布与主量子数 l 无关,且 l 相同时, 其角度分布图总是一样的。在下章讨论成键问题时,角度分布图有直接应用,故比较重 要。图 3-1 为某些原子轨道的角度分布图,图中的“+”、“-”号表示波函数的正、负值
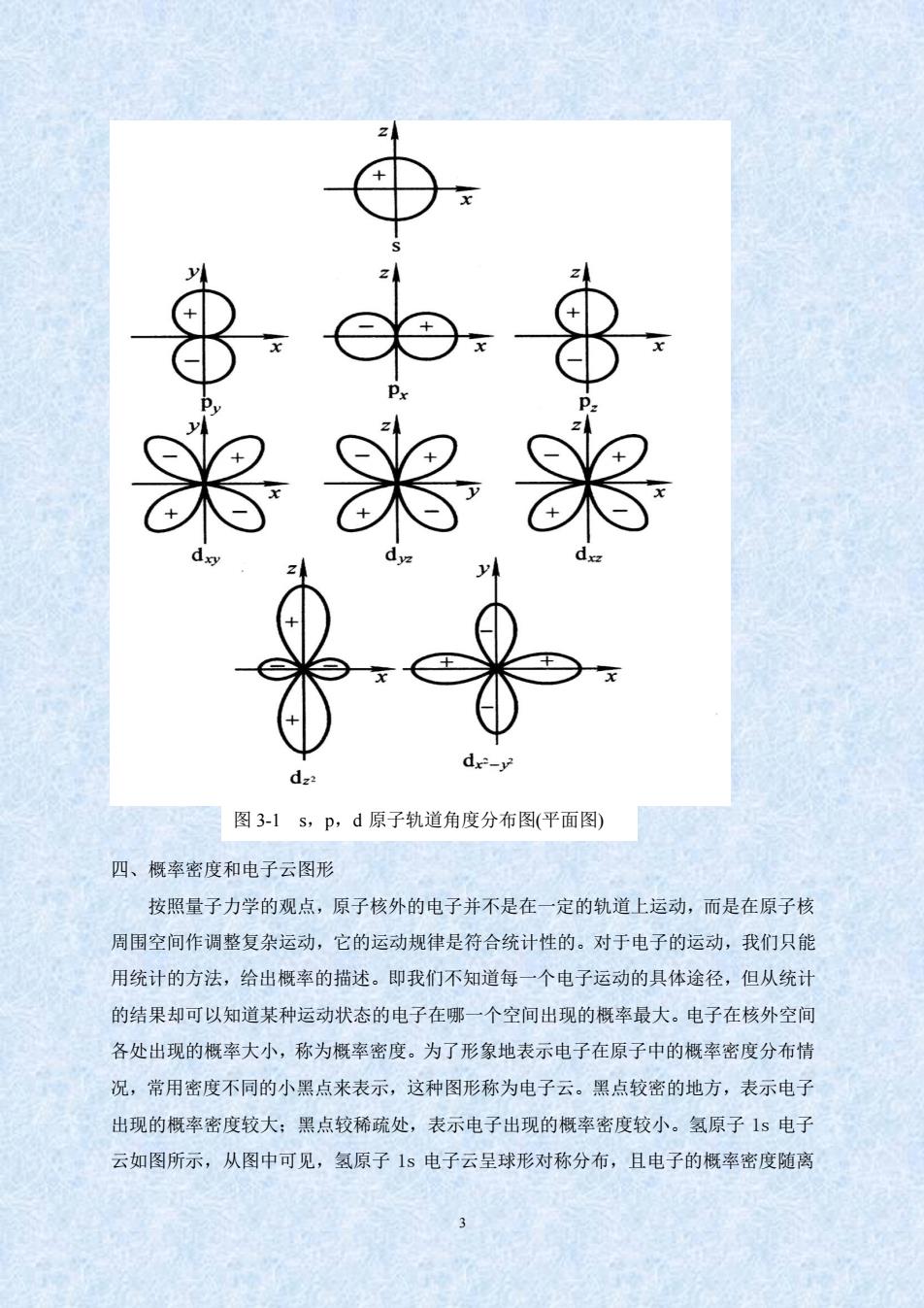
8 岛 图3-1s,P,d原子轨道角度分布图(平面图) 四、概率密度和电子云图形 按照量子力学的观点,原子核外的电子并不是在一定的轨道上运动,而是在原子核 周围空间作调整复杂运动,它的运动规律是符合统计性的。对于电子的运动,我们只能 用统计的方法,给出概率的描述。即我们不知道每一个电子运动的具体途径,但从统计 的结果却可以知道某种运动状态的电子在哪一个空间出现的概率最大。电子在核外空间 各处出现的概率大小,称为概率密度。为了形象地表示电子在原子中的概率密度分布情 况,常用密度不同的小黑点来表示,这种图形称为电子云。黑点较密的地方,表示电子 出现的概率密度较大:黑点较稀疏处,表示电子出现的概率密度较小。氢原子1s电子 云如图所示,从图中可见,氢原子15电子云呈球形对称分布,且电子的概率密度随离
3 四、概率密度和电子云图形 按照量子力学的观点,原子核外的电子并不是在一定的轨道上运动,而是在原子核 周围空间作调整复杂运动,它的运动规律是符合统计性的。对于电子的运动,我们只能 用统计的方法,给出概率的描述。即我们不知道每一个电子运动的具体途径,但从统计 的结果却可以知道某种运动状态的电子在哪一个空间出现的概率最大。电子在核外空间 各处出现的概率大小,称为概率密度。为了形象地表示电子在原子中的概率密度分布情 况,常用密度不同的小黑点来表示,这种图形称为电子云。黑点较密的地方,表示电子 出现的概率密度较大;黑点较稀疏处,表示电子出现的概率密度较小。氢原子 1s 电子 云如图所示,从图中可见,氢原子 1s 电子云呈球形对称分布,且电子的概率密度随离 图 3-1 s,p,d 原子轨道角度分布图(平面图)
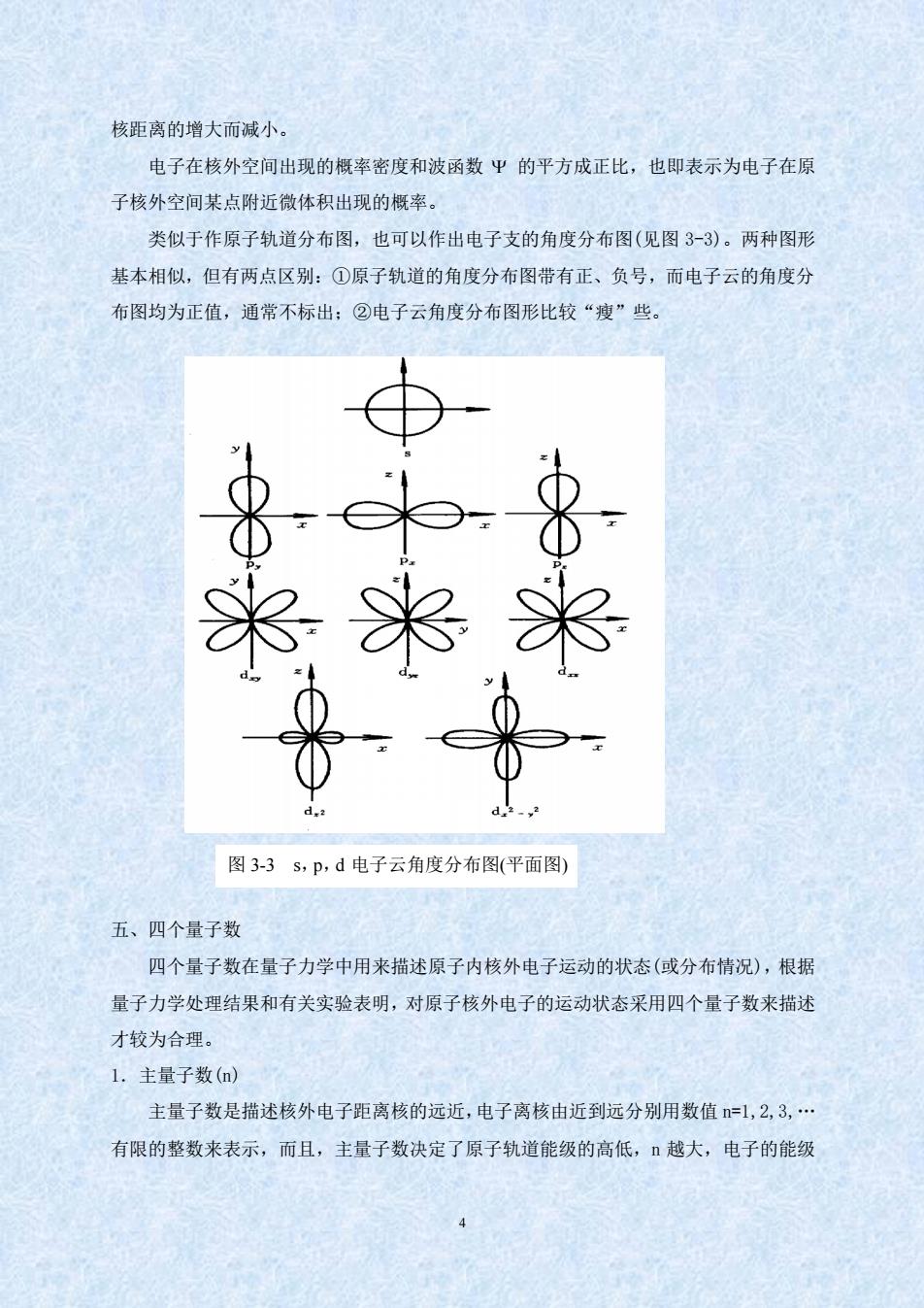
核距离的增大而减小。 电子在核外空间出现的概率密度和波函数平的平方成正比,也即表示为电子在原 子核外空间某点附近微体积出现的概率。 类似于作原子轨道分布图,也可以作出电子支的角度分布图(见图3-3)。两种图形 基本相似,但有两点区别:①原子轨道的角度分布图带有正、负号,而电子云的角度分 布图均为正值,通常不标出:②电子云角度分布图形比较“瘦”些。 米 米 米 图3-3s,p,d电子云角度分布图(平面图) 五、四个量子数 四个量子数在量子力学中用来描述原子内核外电子运动的状态(或分布情况),根据 量子力学处理结果和有关实验表明,对原子核外电子的运动状态采用四个量子数来描述 才较为合理。 L.主量子数() 主量子数是描述核外电子距离核的远近,电子离核由近到远分别用数值=1,2,3,· 有限的整数来表示,而且,主量子数决定了原子轨道能级的高低,越大,电子的能级
4 核距离的增大而减小。 电子在核外空间出现的概率密度和波函数 的平方成正比,也即表示为电子在原 子核外空间某点附近微体积出现的概率。 类似于作原子轨道分布图,也可以作出电子支的角度分布图(见图 3-3)。两种图形 基本相似,但有两点区别:①原子轨道的角度分布图带有正、负号,而电子云的角度分 布图均为正值,通常不标出;②电子云角度分布图形比较“瘦”些。 五、四个量子数 四个量子数在量子力学中用来描述原子内核外电子运动的状态(或分布情况),根据 量子力学处理结果和有关实验表明,对原子核外电子的运动状态采用四个量子数来描述 才较为合理。 1.主量子数(n) 主量子数是描述核外电子距离核的远近,电子离核由近到远分别用数值 n=1,2,3,. 有限的整数来表示,而且,主量子数决定了原子轨道能级的高低,n 越大,电子的能级 图 3-3 s,p,d 电子云角度分布图(平面图)
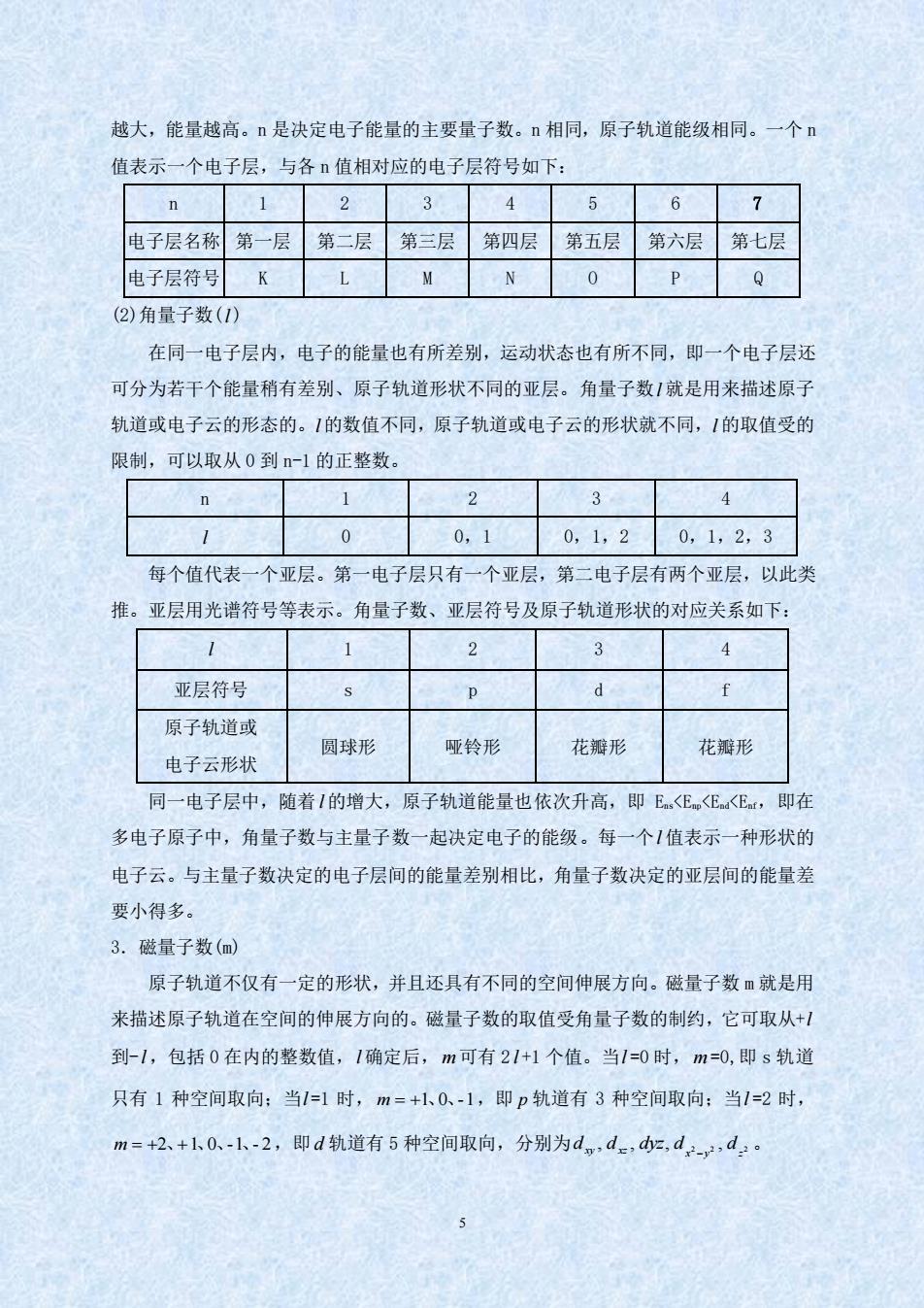
越大,能量越高。n是决定电子能量的主要量子数。n相同,原子轨道能级相同。一个 值表示一个电子层,与各n值相对应的电子层符号如下: n 1234 5 6 7 电子层名称第一层第二层第三层第四层第五层第六层第七层 电子层符号KLMN 0 Q 2)角量子数(1) 在同一电子层内,电子的能量也有所差别,运动状态也有所不同,即一个电子层还 可分为若干个能量稍有差别、原子轨道形状不同的亚层。角量子数1就是用来描述原子 轨道或电子云的形态的。1的数值不同,原子轨道或电子云的形状就不同,1的取值受的 限制,可以取从0到n-1的正整数 n 2 3 4 1 0 0,10,1,20,1,2,3 每个值代表一个亚层。第一电子层只有一个亚层,第二电子层有两个亚层,以此类 推。亚层用光谱符号等表示。角量子数、亚层符号及原子轨道形状的对应关系如下: 1 1 2 3 4 亚层符号 原子轨道或 电子云形状 园球形 哑铃形 花瓣形 花瓣形 同一电子层中,随着1的增大,原子轨道能量也依次升高,即E<E<E。,即在 多电子原子中,角量子数与主量子数一起决定电子的能级。每一个1值表示一种形状的 电子云。与主量子数决定的电子层间的能量差别相比,角量子数决定的亚层间的能量差 要小得多。 3.磁量子数(m) 原子轨道不仅有一定的形状,并且还具有不同的空间伸展方向。磁量子数m就是用 来描述原子轨道在空间的伸展方向的。磁量子数的取值受角量子数的制约,它可取从+ 到-1,包括0在内的整数值,1确定后,m可有21+1个值。当1=0时,m=0,即s轨道 只有1种空间取向:当1=1时,m=+1、0、-1,即p轨道有3种空间取向:当1=2时, m=+2、+1k0-1、-2,即d轨道有5种空间取向,分别为d,d.,d,d:
5 越大,能量越高。n 是决定电子能量的主要量子数。n 相同,原子轨道能级相同。一个 n 值表示一个电子层,与各 n 值相对应的电子层符号如下: n 1 2 3 4 5 6 7 电子层名称 第一层 第二层 第三层 第四层 第五层 第六层 第七层 电子层符号 K L M N O P Q (2)角量子数( l ) 在同一电子层内,电子的能量也有所差别,运动状态也有所不同,即一个电子层还 可分为若干个能量稍有差别、原子轨道形状不同的亚层。角量子数 l 就是用来描述原子 轨道或电子云的形态的。 l 的数值不同,原子轨道或电子云的形状就不同, l 的取值受的 限制,可以取从 0 到 n-1 的正整数。 n 1 2 3 4 l 0 0,1 0,1,2 0,1,2,3 每个值代表一个亚层。第一电子层只有一个亚层,第二电子层有两个亚层,以此类 推。亚层用光谱符号等表示。角量子数、亚层符号及原子轨道形状的对应关系如下: l 1 2 3 4 亚层符号 s p d f 原子轨道或 电子云形状 圆球形 哑铃形 花瓣形 花瓣形 同一电子层中,随着 l 的增大,原子轨道能量也依次升高,即 Ens<Enp<End<Enf,即在 多电子原子中,角量子数与主量子数一起决定电子的能级。每一个 l 值表示一种形状的 电子云。与主量子数决定的电子层间的能量差别相比,角量子数决定的亚层间的能量差 要小得多。 3.磁量子数(m) 原子轨道不仅有一定的形状,并且还具有不同的空间伸展方向。磁量子数 m 就是用 来描述原子轨道在空间的伸展方向的。磁量子数的取值受角量子数的制约,它可取从+ l 到- l ,包括 0 在内的整数值, l 确定后, m 可有 2 l +1 个值。当 l =0 时, m =0,即 s 轨道 只有 1 种空间取向;当 l =1 时, m = +1、0、-1 ,即 p 轨道有 3 种空间取向;当 l =2 时, m = +2、+1、0、-1、- 2 ,即 d 轨道有 5 种空间取向,分别为 , , , 2 2 , 2 x y z dxy dxz dyz d d −