
第二章化学反应速率与化学平衡 教学目标:通过学习使学生不但要掌握化学反应进行的快慢,而且还要掌握 化学反应进行的完全程度,以便能更好的为工农业生产服务。 知识技能:理解勒沙特列原理的含义,掌握浓度、温度、压强等条件对化学 平衡移动的影响:掌握化学反应速率改变与化学平衡移动的关系。 能力培养:通过对化学反应速率与化学平衡知识的运用,培养学生将化学信 息,按题设情境抽象归纳,逻辑地统摄成规律,并能运用此规律,进行推理的创 造能力。 重点、难点化学反应速率与化学平衡知识间的联系:化学知识及相关能力 在实际中的运用。 2.1化学反应速率 一、化学反应速率的表示方法 化学反应速率是指在一定条件下,化学反应中反应物转变为生成物的速率 往往用单位时间内反应物或生成物浓度变化的正值(绝对值)表示,单位:ol.L-1. 时间。时间可以为s、min或其他时间单位。 反应速率=浓度变化 变化所需时间 通过上式计算得出的实际上是平均速率,当时间间隔趋于0时,平均速率即 转化为瞬时速率。如图 产物(P d[R] 反应物(R) 时间1 反应物和产物的浓度随时间的变化
1 第二章 化学反应速率与化学平衡 教学目标:通过学习使学生不但要掌握化学反应进行的快慢,而且还要掌握 化学反应进行的完全程度,以便能更好的为工农业生产服务。 知识技能:理解勒沙特列原理的含义,掌握浓度、温度、压强等条件对化学 平衡移动的影响;掌握化学反应速率改变与化学平衡移动的关系。 能力培养:通过对化学反应速率与化学平衡知识的运用,培养学生将化学信 息,按题设情境抽象归纳,逻辑地统摄成规律,并能运用此规律,进行推理的创 造能力。 重点、难点 化学反应速率与化学平衡知识间的联系;化学知识及相关能力 在实际中的运用。 2.1 化学反应速率 一、化学反应速率的表示方法 化学反应速率是指在一定条件下,化学反应中反应物转变为生成物的速率, 往往用单位时间内反应物或生成物浓度变化的正值(绝对值)表示,单位:mol.L-1. 时间。时间可以为 s、min 或其他时间单位。 反应速率 = 变化所需时间 浓度变化 即 通过上式计算得出的实际上是平均速率,当时间间隔趋于 0 时,平均速率即 转化为瞬时速率。如图

在浓度随时间变化的图上,某时刻的速率即该时刻切线的斜率。以后提到的 速率均指瞬时速率。显然,反应刚开始,速率大,然后不断减小,体现了反应速 率变化的实际情况。 2.2化学反应速率理论简介 1、化学反应历程(机理) 一个化学反应,在一定条件下,反应物变成生成物实际经过的途径。 基元反应:在反应中反应物分子直接转化成生成物的反应一简单反应 复杂反应:在反应中反应物分子经过多步才转化成生成物的反应—一非基元 反应。 基元反应 CO(g)+NOz(g)=COz(g)+NO(g) 非基元反应 H2(g)+I2(g)=2HI(g 12(g)=2I(g) 快 H2(g)+2I(g)=2HI(g)慢 2、化学反应速率理论 (1)有效碰撞理论 化学反应发生的必要条件是反应物分子(或原子、离子)间的碰撞。 只有极少数活化分子的碰撞才能发生化学反应,称“有效碰撞”:活化分子 是反应物分子中能量较高的分子,其比例很小 理论要点: ※有效碰撞:能发生反应的碰撞: ※活化分子:具有较大的动能并且能发生有效碰撞的分子: ※活化能:活化分子所具有的最低能量与反应物分子的平均能量之差: ※其他条件相同时,活化能越低的化学反应,反应速率越高。 活化能()是化学反应的“能垒”,越高,反应越慢:越低,反应越 快。可以通过实验测定。 般化学反应的活化能约在40~400灯.mo1之间:
2 在浓度随时间变化的图上,某时刻的速率即该时刻切线的斜率。以后提到的 速率均指瞬时速率。显然,反应刚开始,速率大,然后不断减小,体现了反应速 率变化的实际情况。 2.2 化学反应速率理论简介 1、化学反应历程(机理) 一个化学反应,在一定条件下,反应物变成生成物实际经过的途径。 基元反应:在反应中反应物分子直接转化成生成物的反应—简单反应。 复杂反应:在反应中反应物分子经过多步才转化成生成物的反应-非基元 反应。 基元反应 CO(g) + NO2(g) = CO2(g) + NO(g) 非基元反应 H2(g) + I2(g) = 2HI(g I2(g) =2 I(g) 快 H2(g) + 2I(g) = 2HI(g) 慢 2、化学反应速率理论 (1)有效碰撞理论 化学反应发生的必要条件是反应物分子(或原子、离子)间的碰撞。 只有极少数活化分子的碰撞才能发生化学反应,称“有效碰撞”;活化分子 是反应物分子中能量较高的分子,其比例很小; 理论要点: ※有效碰撞:能发生反应的碰撞; ※ 活化分子:具有较大的动能并且能发生有效碰撞的分子; ※ 活化能:活化分子所具有的最低能量与反应物分子的平均能量之差; ※ 其他条件相同时,活化能越低的化学反应,反应速率越高。 活化能(Ea)是化学反应的“能垒”,Ea越高,反应越慢;Ea越低,反应越 快。Ea可以通过实验测定。 一般化学反应的活化能约在40~400 kj.mol-1之间;

多数化学反应的活化能约在60~250K灯.mol1之间: 反应的活化能小于40k.mo1时,反应速度很快: 反应的活化能大于400kj.mo时,反应速度很慢: 中和化学反应的活化能约在13~25k灯.mo1之间。 (2)过渡状态理论 化学反应并不是通过反应物分子的简单碰撞完成的,在反应物到产物的转 变过程中,先形成一种过渡状态,即反应物分子活化形成配合物的中间状态 如A+BC- →「AB.CJ →ABC 2.3影响化学反应速率的主要因素 内因:反应的活化能 外因:浓度、温度、催化剂 、浓度或分压对反应速率的影响 1,基元反应:对于简单反应,反应物分子在有效碰撞中经过一次化学变化就能 转化为产物的反应。 2.基元反应的化学反应速率方程式:可由质量作用定律描述。 在一定温度下,对某一基元反应,反应速率与各反应物浓度(以化学方程 式中该物质的计量数为指数)的乘积成正比 如:aA+bB=gG+dD为基元反应, 则:v=kC(A)C(B) 称作质量作用定律数学表达式。 而对于非基元反应,有: v=kc"(A).c"(B) 称作反应速率方程式。其中m、n要通过实验来确定。 (a+b)或(mtn)称为反应级数 例1S.0,+3T=2S0+1非基元反应 v=k(S,0,r) 该反应为2级反应。 k称为反应速率常数,可用来表征反应的速率
3 多数化学反应的活化能约在60~250 kj.mol-1之间; 反应的活化能小于 40 kj.mol-1时,反应速度很快; 反应的活化能大于 400 kj.mol-1时,反应速度很慢; 中和化学反应的活化能约在13~25 kj.mol-1之间。 (2)过渡状态理论 化学反应并不是通过反应物分子的简单 碰撞完成的,在反应物到产物的转 变过程中,先形成一种过渡状态,即反应物分子活化形成配合物的中间状态。 如 A + BC 「A.B.C」 ABC 2.3 影响化学反应速率的主要因素 内因:反应的活化能 外因:浓度、温度、催化剂 一、浓度或分压对反应速率的影响 1.基元反应: 对于简单反应,反应物分子在有效碰撞中经过一次化学变化就能 转化为产物的反应。 2.基元反应的化学反应速率方程式:可由质量作用定律描述。 在一定温度下,对某一基元反应, 反应速率与各反应物浓度(以化学方程 式中该物质的计量数为指数)的乘积成正比 如:aA + bB = gG + dD 为基元反应, 则: v kc (A) c (B) a b = 称作质量作用定律数学表达式。 而对于非基元反应,有: v kc (A) c (B) m n = 称作反应速率方程式。其中m、n要通过实验来确定。 (a+b)或(m+n)称为反应级数。 例1 S2O8 2- + 3I- = 2SO4 2- + I3 - 非基元反应 该反应为2级反应。 k 称为反应速率常数, 可用来表征反应的速率。 ( )( ) 2 2 8 − − v = k S O I

k与温度、催化剂有关,而与浓度无关。对于n级反应其单位是(mol'dm-s 反应级数的意义: ①表示了反应速率与物质的量浓度的关系; ②零级反应表示了反应速率与反应物浓度无关 速率常数的单位 零级反应:v=k(c)° k的量纲为mol·dn·s 级反应:U=kC: k的量纲为s1 二级反应:D=k(c) k的量纲为mol3·dn·s 气体反应可用气体分压表示 2N0.→2N0+0: v=kcNo2,2:或v=kP0oa:hc≠& 二、温度对反应速率的影响 范特霍夫规则 般情况下:在一定温度范围内,对化学反应温度每升高10度反应速率大约 增加到原来的24倍。 温度升高使反应速率显著提高的原因是:升温是反应物分子的能量增加,大 量的非活化分子获得能量后变成活化分子,单位体积内活化分子的百分数大大增 加,由小碰撞次数增多,从而反应速率明显增大。 三、催化剂对反应速率的影响 催化剂能改变反应速率的作用叫催化作用。 正催化:加速反应速率负催化:减慢反应速率 1.催化剂影响反应速率的原因 催化作用的实质是改变了反应的机理,降低了反应的活化能,因而提高了反 应速率。不改变反应前后物质的组成和质量,也不改变平衡常数K:缩短平衡到 达的时间,加快平衡的到来。 2.特点
4 k与温度、催化剂有关,而与浓度无关。对于n级反应其单位是(moldm-3 ) (n-1)s -1 反应级数的意义: ① 表示了反应速率与物质的量浓度的关系; ②零级反应表示了反应速率与反应物浓度无关 速率常数的单位 零级反应: = k(cA) 0 k的量纲为mol·dm-3·s -1 一级反应: = kcA; k的量纲为s -1 二级反应: = k(cA) 2 k的量纲为mol3·dm-1·s -1 气体反应可用气体分压表示 2NO2 ⎯⎯⎯⎯→ 2NO + O2; v = kc c(NO2 ) 2 ;或 v = kpp(NO2 ) 2 ; kc kP 二、温度对反应速率的影响 范特霍夫规则 一般情况下:在一定温度范围内,对化学反应温度每升高10度反应速率大约 增加到原来的2~4倍。 温度升高使反应速率显著提高的原因是:升温是反应物分子的能量增加,大 量的非活化分子获得能量后变成活化分子,单位体积内活化分子的百分数大大增 加,由小碰撞次数增多,从而反应速率明显增大。 三、催化剂对反应速率的影响 催化剂能改变反应速率的作用叫催化作用。 正催化:加速反应速率 负催化:减慢反应速率 1.催化剂影响反应速率的原因 催化作用的实质是改变了反应的机理,降低了反应的活化能,因而提高了反 应速率。不改变反应前后物质的组成和质量,也不改变平衡常数K;缩短平衡到 达的时间,加快平衡的到来。 2.特点:
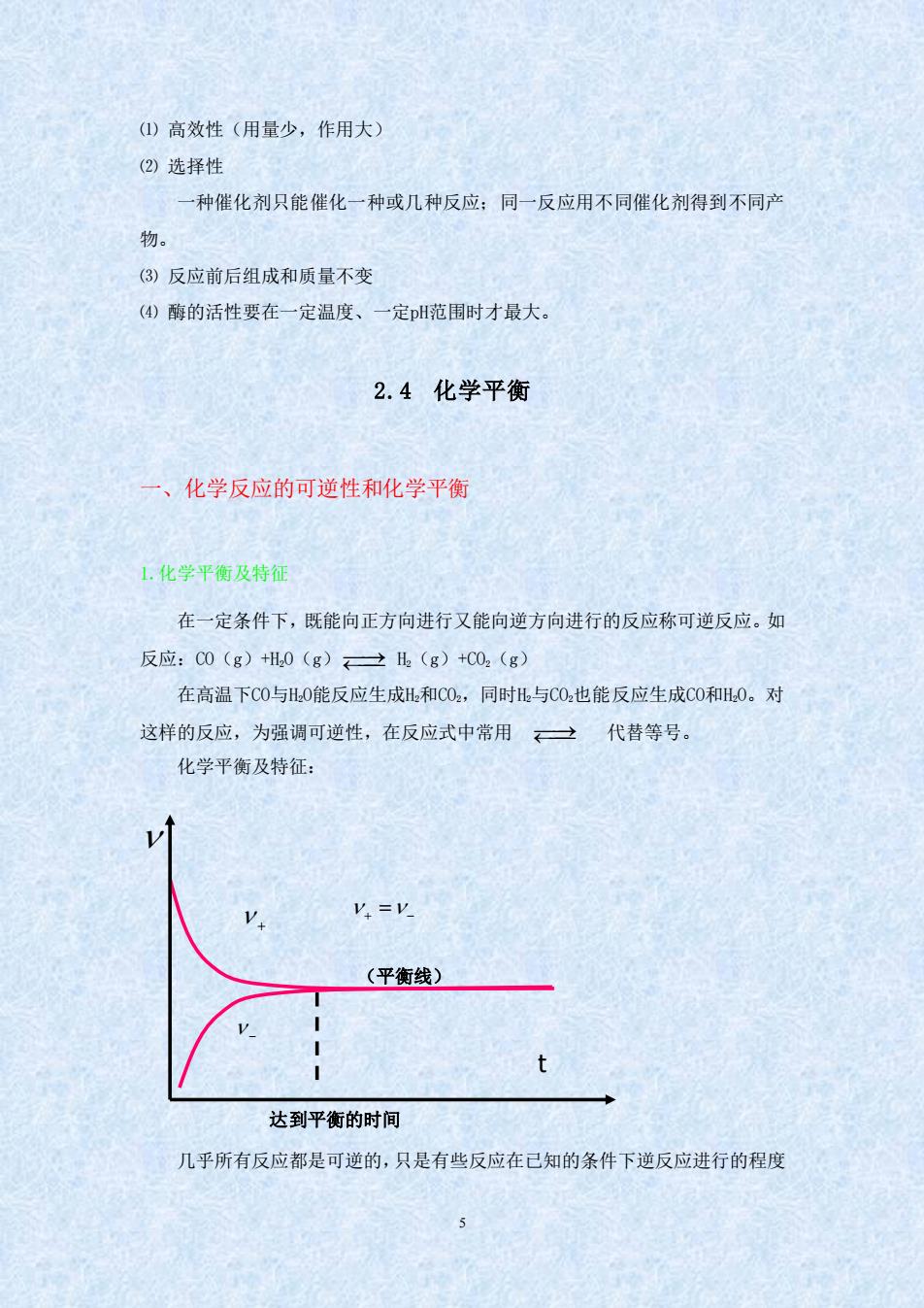
(①)高效性(用量少,作用大) (②)选择性 一种催化剂只能催化一种或几种反应:同一反应用不同催化剂得到不同产 物。 (3)反应前后组成和质量不变 (④)酶的活性要在一定温度、一定H范围时才最大, 2.4化学平衡 ·、化学反应的可逆性和化学平衡 1。化学平衡及特征 在一定条件下,既能向正方向进行又能向逆方向进行的反应称可逆反应。如 反应:00(g)H.0(g)→l(g)+C0,(g 在高温下C0与H0能反应生成H和C0.,同时H与C0也能反应生成C0和H0。对 这样的反应,为强调可逆性,在反应式中常用一代替等号。 化学平衡及特征: V.=V (平衡线) 达到平衡的时间 几乎所有反应都是可逆的,只是有些反应在已知的条件下逆反应进行的程度
5 ⑴ 高效性(用量少,作用大) ⑵ 选择性 一种催化剂只能催化一种或几种反应;同一反应用不同催化剂得到不同产 物。 ⑶ 反应前后组成和质量不变 ⑷ 酶的活性要在一定温度、一定pH范围时才最大。 2.4 化学平衡 一、化学反应的可逆性和化学平衡 1.化学平衡及特征 在一定条件下,既能向正方向进行又能向逆方向进行的反应称可逆反应。如 反应:CO(g)+H2O(g) ⎯⎯⎯⎯→ H2(g)+CO2(g) 在高温下CO与H2O能反应生成H2和CO2,同时H2与CO2也能反应生成CO和H2O。对 这样的反应,为强调可逆性,在反应式中常用 ⎯⎯⎯⎯→ 代替等号。 化学平衡及特征: 几乎所有反应都是可逆的,只是有些反应在已知的条件下逆反应进行的程度 − 达到平衡的时间 + + − = (平衡线) t