
7.1电解质溶液的导电机理一 两类导体 1.第一类导体 又称电子导体,如金属、石墨等。 A.自由电子作定向移动而导电 B.导电过程中导体本身不发生变化 C.温度升高,电阻也升高 D.导电总量全部由电子承担 上一内容 下一内容 ◇回主目录 b返回 2009-6-2
上一内容 下一内容 回主目录 返回 2009-6-2 7。1 电解质溶液的导电机理-两类导体 A.自由电子作定向移动而导电 B.导电过程中导体本身不发生变化 C.温度升高,电阻也升高 D.导电总量全部由电子承担 又称电子导体,如金属、石墨等。 1. 第一类导体

7.1电解质溶液的导电机理两类导体 2、第二类导体 又称离子导体,如电 解质溶液、熔融电解质等。 A.正、负离子作反向移动而导电 B.导电过程中有化学反应发生 C.温度升高,电阻下降 D.导电总量分别由正、负离子分担 固体电解质,如AgBr、PbL,等,也属于离子导体,但 它导电的机理比较复杂,导电能力不高,本章以讨论电 解质水溶液为主。 上一内容 下一内容 ◇回主目录 5返回 2009-6-2
上一内容 下一内容 回主目录 返回 2009-6-2 7。1 电解质溶液的导电机理两类导体 A.正、负离子作反向移动而导电 B.导电过程中有化学反应发生 C.温度升高,电阻下降 D.导电总量分别由正、负离子分担 ⒉ 第二类导体 又称离子导体,如电 解质溶液、熔融电解质等。 *固体电解质,如 等,也属于离子导体,但 它导电的机理比较复杂,导电能力不高,本章以讨论电 解质水溶液为主。 AgBr PbI 、 2

阴极、阳极 电极在导电过程中因电子得失而引起的化学反应称 为电极反应。两电极的反应和叫电池反应。并规定 阴极: 发生还原作用的极称为阴极,在原 电池中,阴极是正极;在电解池 (Cathode) 中,阴极是负极。 阳极: 发生氧化作用的极称为阳极,在原 电池中,阳极是负极;在电解池 (Anode) 中,阳极是正极。 4上一内容 下一内容 ◇回主目录 b返回 2009-6-2
上一内容 下一内容 回主目录 返回 2009-6-2 阴极、阳极 发生还原作用的极称为阴极,在原 电池中,阴极是正极;在电解池 中,阴极是负极。 阴极: (Cathode) 发生氧化作用的极称为阳极,在原 电池中,阳极是负极;在电解池 中,阳极是正极。 阳极: (Anode) 电极在导电过程中因电子得失而引起的化学反应称 为电极反应。两电极的反应和叫电池反应。并规定

正极、负极 正极: 电势高的极称为正极,电流从正极 流向负极。在原电池中正极是阴 极;在电解池中正极是阳极。 负极: 电势低的极称为负极,电子从负极 流向正极。在原电池中负极是阳 极;在电解池中负极是阴极。 上一内容 下一内容 ◇回主目录 5返回 2009-6-2
上一内容 下一内容 回主目录 返回 2009-6-2 正极、负极 电势低的极称为负极,电子从负极 流向正极。在原电池中负极是阳 极;在电解池中负极是阴极。 负极: 电势高的极称为正极,电流从正极 流向负极。在原电池中正极是阴 极;在电解池中正极是阳极。 正极:
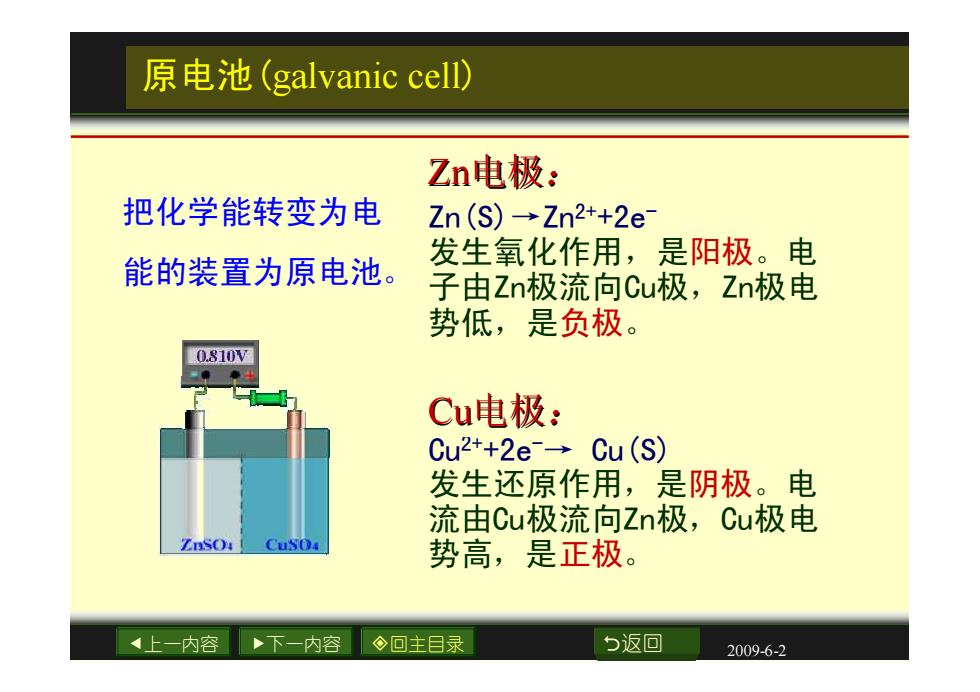
原电池(galvanic cell) Zn电极: 把化学能转变为电 Zn(S)→Zn2++2e 能的装置为原电池。 发生氧化作用,是阳极。电 子由Zn极流向Cu极,Zn极电 势低,是负极。 0.810W Cu电极: Cu2++2e→Cu(S) 发生还原作用,是阴极。电 流由Cu极流向Zn极,Cu极电 ZnSO: 势高,是正极。 上一内容 下一内容 ◇回主目录 b返回 2009-6-2
上一内容 下一内容 回主目录 返回 2009-6-2 原电池(galvanic cell) Cu2++2e-→ Cu(S) 发生还原作用,是阴极。电 流由Cu极流向Zn极,Cu极电 势高,是正极。 Cu电极: Zn(S)→Zn2++2e- 发生氧化作用,是阳极。电 子由Zn极流向Cu极,Zn极电 势低,是负极。 Zn电极: 把化学能转变为电 能的装置为原电池