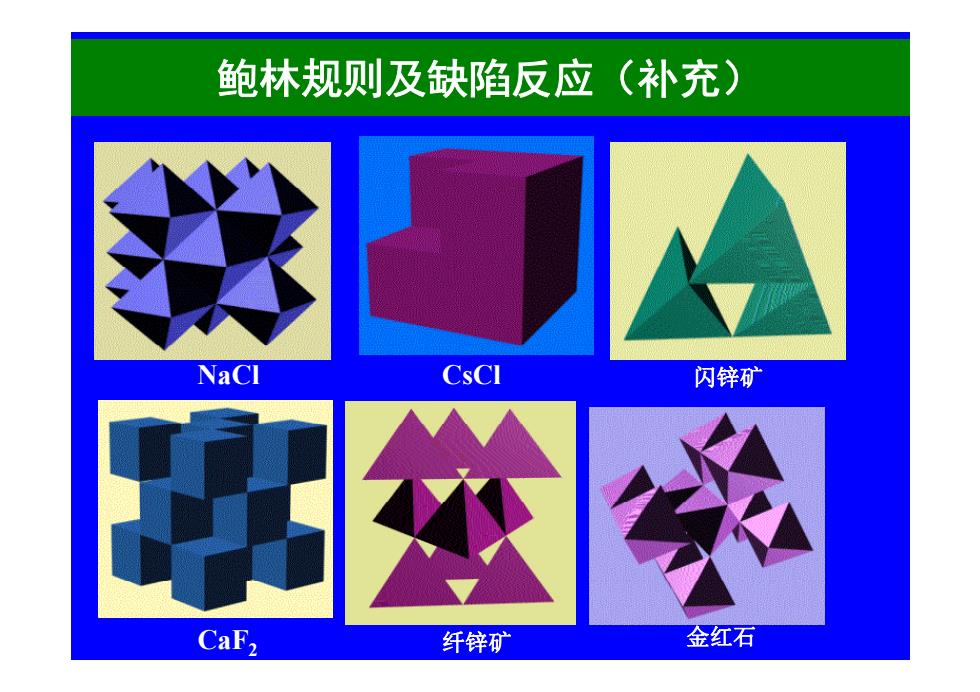
鲍林规则及缺陷反应(补充) NaCl 闪锌矿 CaF, 纤锌矿 金红石
鲍林规则及缺陷反应(补充) NaCl CsCl 闪锌矿 CaF 2 纤锌矿 金红石

Electrostatic Bond Valence Principle Pauling第二规则(电价规则):设Z为正离 子带的电荷数,u为其配位数,从正离子到每一个 配位负离子间的静电键强度$定义为: Bond valence;bond strength 或者,在一个稳定的离子型结构中,负离子的 电价等于或近乎等于从邻近的正离子至该负离子各 静电键强度之总和:即 实际上,该规则对正离子的电价也成立: Z=∑S,=∑
Electrostatic Bond Valence Principle Pauling 第二规则(电价规则):设Z +为正离 子带的电荷数,u为其配位数 从正离子到每 个 为其配位数 ,从正离子到每 一 个 配位负离子间的静电键强度 S定义为: Z S 配位负离子间的静电键强度 S定义为: u S 或者,在 一个稳定的离子型结构中,负离子的 Bond valence; bond strength 或者,在 个稳定的离子型结构中,负离子的 电价等于或近乎等于从邻近的正离子至该负离子各 静电键强度之总和:即 i i i i i u Z Z S i i ui 实际上,该规则对正离子的电价也成立: Z i i i i i u Z Z S

Z为负离子电荷数(电价),S指某一负离子 至每一个以负离子为顶点的多面体中央的正离子的 静电键强度(electrostatic bond strength,.ebs),这就是 电价规则。 Example1:NaC1,其静电键强度为 6 则C1的电价 乙a=∑s,=6×61 上下、前后、左右共6个八面体共用一个C1 顶点
Z -为负离子电荷数(电价),Si指某一负离子 至每 个以负离子为顶点的多面体中央的正离子的 至每一个以负离子为顶点的多面体中央的正离子的 静电键强度(electrostatic bond strength, (electrostatic bond strength, ebs),这就是 电价规则。 Example 1 NaCl 其静电键强度为 1 Example 1:NaCl,其静电键强度为 S 则Cl-的电价 6 S i 1 1 则Cl 的电价 Z S i 6 上下、前后、左右共6个八面体共用一个Cl- 顶点 1 6 6 i Z Cl S i 顶点
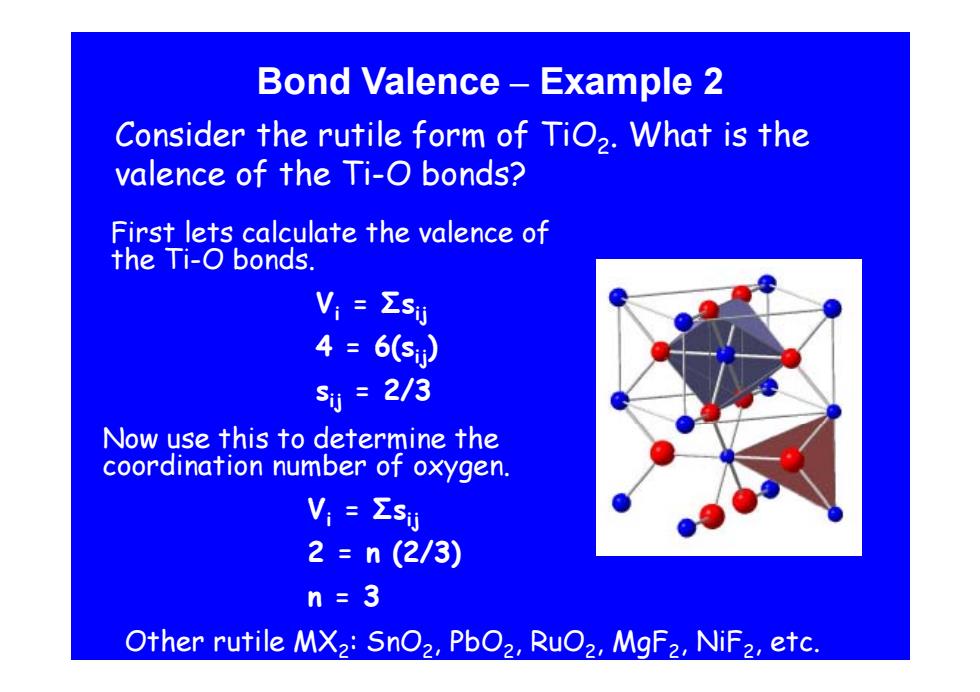
Bond Valence -Example 2 Consider the rutile form of TiO2.What is the valence of the Ti-O bonds? First lets calculate the valence of the Ti-O bonds. V,=Σsy 4=6(5) s1=2/3 Now use this to determine the coordination number of oxygen. Vi Esij 2=n(2/3) n=3 Other rutile MX2:SnO2,PbO2,RuO2,MgF2,NiF2,etc
Bond Valence – Example 2 Consider the rutile form of TiO2. What is the valence of the Ti-O bonds? First lets calculate the valence of the Ti-O bonds. O bonds. Vi = Σsij 4 = 6(s 4 = 6(s )ij sij = 2/3 Now use this to determine the coordination number of oxygen. Vi = Σsij 2 = n (2/3) n = 3 Other rutile MX2: SnO2, PbO2, RuO2, MgF2, NiF2, etc

Bond Valence-Example 3 What is the oxygen coordination in the mineral zircon(锆石,锆英石),Zrsio4,where Si"4is tetrahedrally coordinated and Zr+4 is eight coordinated? First lets calculate the valence of the Si-O bonds. V,=Σsj 4=455i-o) S5i-0=1
Bond Valence Bond Valence – Example 3 Example 3 What is the oxygen coordination in the mineral zircon(锆石,锆英石) ZrSiO4 where Si+4 zircon(锆石,锆英石), ZrSiO is 4, where Si is tetrahedrally coordinated and Zr+4 is eight coordinated? First lets calculate the valence of the Si valence of the Si-O bonds. O bonds. Vi = Σsij 4 = 4(sSi-O) sSi-O = 1