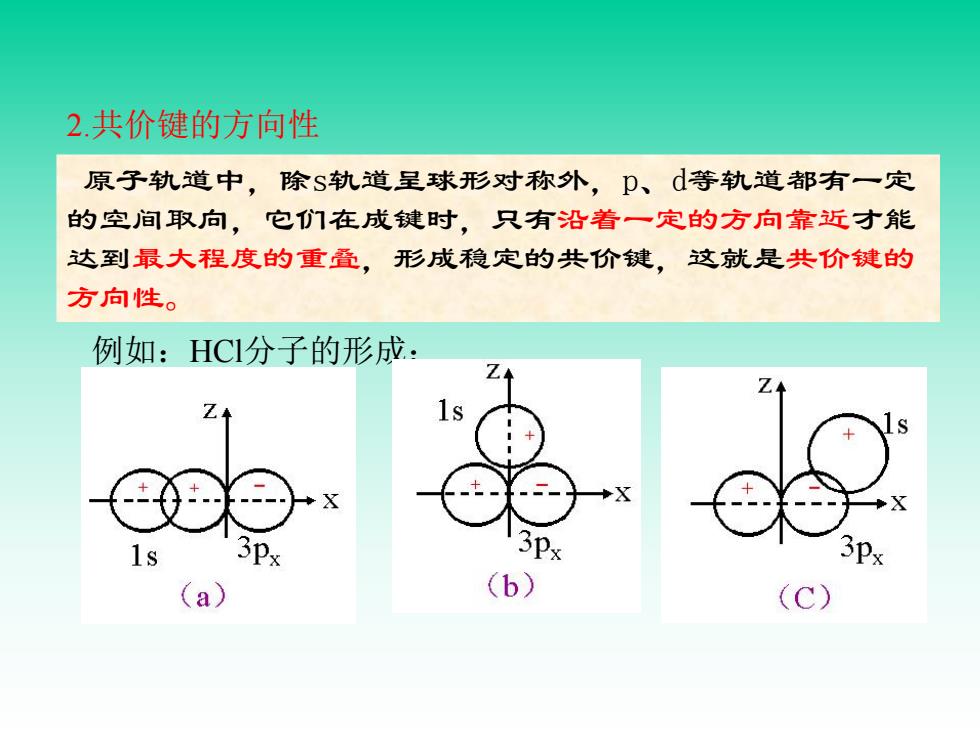
2.共价键的方向性 原子轨道中,除S轨道呈球形对称外,p、d等轨道都有一定 的空间取向,它们在成键时,只有沿着一定的方向靠近才能 达到最大程度的重叠,形成稳定的共价键,这就是共价键的 方向性。 例如:HC分子的形成: 3p, 3P× 3Px a (b)》 (C)
原子轨道中,除s轨道呈球形对称外,p、d等轨道都有一定 的空间取向,它们在成键时,只有沿着一定的方向靠近才能 达到最大程度的重叠,形成稳定的共价键,这就是共价键的 方向性。 例如:HCl分子的形成: 2.共价键的方向性

(三)、共价键的类型 1、6键 为了达到原子轨道最大程度的重叠,轨道沿着键轴 方向以“头碰头”方式进行重叠而形成的共价键称 为G,键。 口键中轨道重叠部分沿键轴呈圆柱形对称分布,X轴为圆 柱型抽心
(三)、共价键的类型 1、σ 键 为了达到原子轨道最大程度的重叠,轨道沿着键轴 方向以“头碰头”方式进行重叠而形成的共价键称 为σ 键。 σ 键中轨道重叠部分沿键轴呈圆柱形对称分布,x 轴为圆 柱型轴心
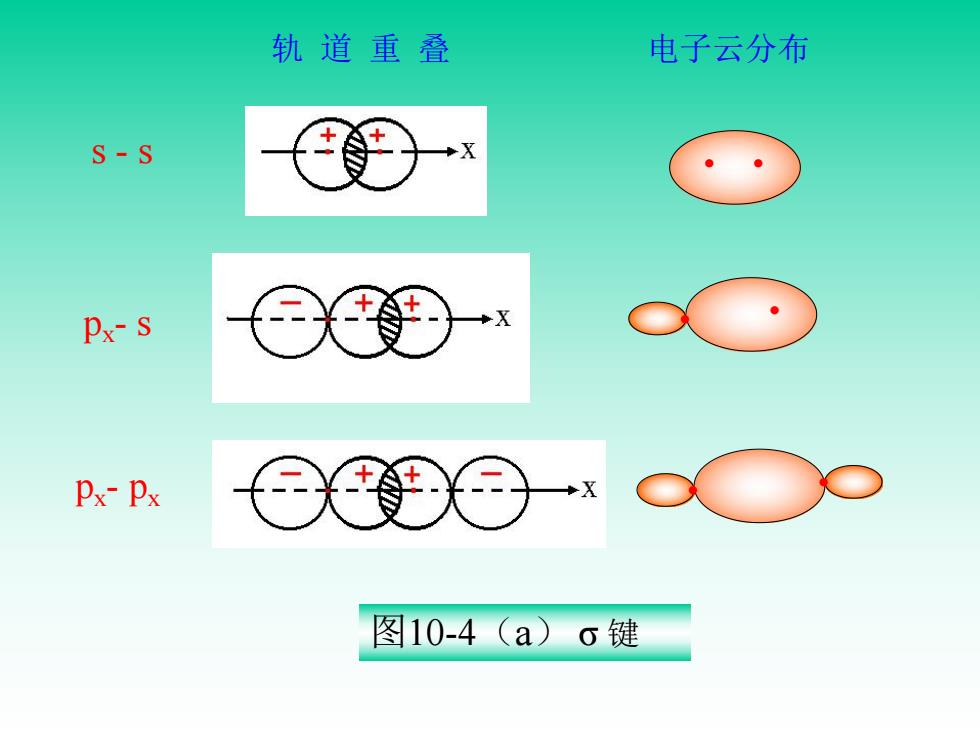
轨道重叠 电子云分布 S-S Px-S Px-Px X 图10-4(a)o键
s - s • • px- s • • px- px • • 轨 道 重 叠 电子云分布 图10-4(a) σ 键
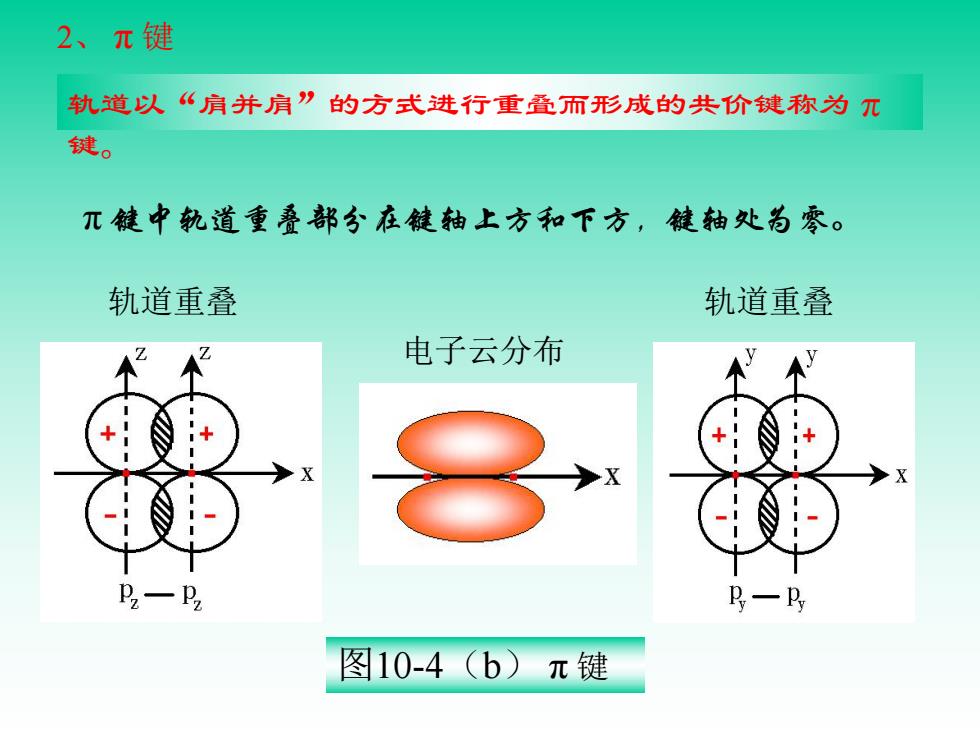
2、π键 轨道以“肩并肩”的方式进行重叠而形成的共价键称为兀 键。 兀键中轨道重叠部分在键轴上方和下方,键轴处为零。 轨道重叠 轨道重叠 电子云分布 P2一Pz P一P 图10-4(b)π键
轨道以“肩并肩”的方式进行重叠而形成的共价键称为π 键。 轨道重叠 轨道重叠 电子云分布 图10-4(b) π 键 2、 π 键 π 键中轨道重叠部分在键轴上方和下方,键轴处为零

例如,N原子的电子排布式为:1s22s22p2p12p2,其中 3个单电子分别占据3个互相垂直的p轨道。当两个N原 子结合成N2分子时,各以1个Px轨道沿键轴以“头碰头” 方式重叠形成一个6键后,余下的两个2pv和两个2P,轨道 只能以“肩并肩”的方式进行重叠,形成两个兀键。 在N2分子中有1个G键和2 个 个元键,其分子结构式可用 N=N表示。 共价单键一般是键,双 键中有1个g键和1个π键, 三键中有1个G键和2个九键。 图10-5N,分子形成示意图
例如,N原子的电子排布式为:1s 22s 22px 12py 12pz 1 ,其中 3 个单电子分别占据 3 个互相垂直的 p 轨道。当两个N 原 子结合成 N2 分子时,各以 1 个 px 轨道沿键轴以“头碰头” 方式重叠形成一个 σ 键后,余下的两个 2py 和两个 2pz轨道 只能以“肩并肩”的方式进行重叠,形成两个 π 键。 图10-5 N2分子形成示意图 在N2分子中有1个σ 键和2 个π 键,其分子结构式可用 N N表示。 共价单键一般是σ键,双 键中有1个σ键和1个π 键, 三键中有1个σ键和2个π键