
工程化学教案 第五章 工程化学教案—第五章物质结构基础 主讲教师:董文魁、许力、李静萍等 使用教材:许力等编著,《工程化学》,兰州大学出版社 授课对象:非化学类各专业学生
工程化学教案 第 五章 • • 1 工程化学教案——第五章 物质结构基础 主讲教师:董文魁、许力、李静萍等 使用教材:许力等编著,《工程化学》,兰州大学出版社 授课对象:非化学类各专业学生

工程化学教案 第五章 第五章物质结构基础(讲授时数:8学时) 一,学习目的和要求 1.掌握原子核外电子分布的一般规律(描述核外电子运动状态的四个量子数的物理意 义和可能取值,核外电子排布原理,电子排布式和轨道表示式)及其与元素周期表 的关系: 2.了解原子核外电子运动的基本特征,5,P,d轨道波函数与电子云的空间分布情况: 3.了解化学健的本质及共价健健长、健角等概念: 4,熟悉杂化轨道理论,能用该理论判定某些分子的空间构型: 5。了解分子间力和晶体结构及对物理性质的影响: 6。了解原子光谱和分子振动光谱的基本原理及应用情况 二。本章节重点、难点 核外电子分布的一般规律:杂化轨道理论:分子间力和晶体结构及对物理性质的影响 三.学时分配 原子结构理论的近代概念 (2学时) 多电子原子的电子分布和周期系 (2学时) 化学键与分子间作用力 (2学时) 分子间的作用力和氢键 (1学时) 晶体结构 (1学时) 四。教学内容: 第一节原子结构的近代概念 物质发生化学反应主要是核外电子的排布等诸方面的改变,其原子核却无变化。 一、微观粒子的波粒二象性 我们已知,光不仅有微粒的性质,而且有波动性即光具有波粒二象性。 原子中的电子是一种有确定体积(d1015m)和质量(9c011×1031kg)的粒子。这一 点无须证明。电子运动是否也象光子一样,表现出波动的性质呢? 1927年美国物理学家戴维逊通过电子衍射实验证实了电子运动时确实具有波动性。 后来人们相继发现质子、中子等微观粒子均能产生衍射现象,同样具有波动性。 所以,微观粒子如电子、质子、中子等都具有波粒二象性,它们波动性与微粒性通过 如下式子联系起来: 动量p=mv=hM,能量E=N m、v是微粒的质量与速度,属于微粒性质。h是普朗克常量,数值为6.626XI01s
工程化学教案 第 五章 2 第五章 物质结构基础(讲授时数: 8 学时) 一. 学习目的和要求 1. 掌握原子核外电子分布的一般规律(描述核外电子运动状态的四个量子数的物理意 义和可能取值,核外电子排布原理,电子排布式和轨道表示式)及其与元素周期表 的关系; 2. 了解原子核外电子运动的基本特征,s,p,d 轨道波函数与电子云的空间分布情况; 3. 了解化学键的本质及共价键键长、键角等概念; 4. 熟悉杂化轨道理论,能用该理论判定某些分子的空间构型; 5. 了解分子间力和晶体结构及对物理性质的影响; 6. 了解原子光谱和分子振动光谱的基本原理及应用情况. 二. 本章节重点、难点 核外电子分布的一般规律; 杂化轨道理论; 分子间力和晶体结构及对物理性质的影响 三. 学时分配 原子结构理论的近代概念 (2 学时) 多电子原子的电子分布和周期系 (2 学时) 化学键与分子间作用力 (2 学时) 分子间的作用力和氢键 (1 学时) 晶体结构 (1 学时) 四. 教学内容: 第一节 原子结构的近代概念 物质发生化学反应主要是核外电子的排布等诸方面的改变,其原子核却无变化。 一、微观粒子的波粒二象性 我们已知,光不仅有微粒的性质,而且有波动性即光具有波粒二象性。 原子中的电子是一种有确定体积(d=10-15m)和质量(9 ִ 011×10-31 ̣kg)的粒子。这一 点无须证明。电子运动是否也象光子一样,表现出波动的性质呢? 1927 年美国物理学家戴维逊通过电子衍射实验证实了电子运动时确实具有波动性。 后来人们相继发现质子、中子等微观粒子均能产生衍射现象,同样具有波动性。 所以,微观粒子如电子、质子、中子等都具有波粒二象性,它们波动性与微粒性通过 如下式子联系起来: 动量 p = mv = h/λ ,能量 E = hv m、v 是微粒的质量与速度,属于微粒性质。h 是普朗克常量,数值为 6.626╳10-34 J.S

工程化学教案 第五章 、v是波长与频率,属于波的性质 二、几率、几率密度与电子云 原子中的 高速运动 它的运动无确定的轨道,但原子中的电子在核外出现的机全 在原子核外的分布还是有规律的。核外空间某些区域电子出现的几率较大,而一些区域则出 现的几率较小。 电子在原子核外空间某处单位体积内出现的几率称为几率密度。 电子云则是用密度不同的小黑点来表示电子在空间单位体积内出现的机会即几率密度 的相对大小,黑点较密处,表示电子出现的几率密度较大,黑点较稀处,表示电子出现的几 率密度较小 三、核外电子运动状态的描述-一薛定谔方程一波函数中一三个量子数 炮弹在空中飞行的运动状态,可以用弹道方程来描述,弹道方程的每一组合理解 亦即弹道函数的每一个值,就表示炮弹运动的一种状态,与此类似,电子的运动也用相应的 方程…亦即薛定谔方程(见书P204)米描述,它是描述核外电子运动状态的基本方程, 空间坐 生微 方程和关于时间的一阶 微分方程 5程的 组合 解办 即波函数中及其对应的能量E就表示了原子中电子的一种可能运动状态,是粒子坐标(空 间位置)的函数,波函数进一步求解的结果是三个量子数,再加上电子自旋量子数总共四个 量子数一起决定电子的运动状态。 核外电子运动状态的描述-薛定谔方程.-波函数中-三个量子数(n,1,m,n为主 量子数,L为角量子数,m为磁量子数) 。决定原子轨道 (m/ →决定电子运动状态 ms 波函数俗称原子轨道 描述核外电子运动状态的四个量子数 1、主量子数(n) 代表电子层,主量子数为n,表示第n层电子层。是电子能量的 主要决定因素。n可取正整数即n=1、2、3n。 K M N n 第一层 第二层 第三层第四层 值越大,电子层越远离原子核,其能级越高。 2、角量子数(L)代表电子亚层,是电子能量的次要决定因素,决定原子轨道的形状。 1取0、1、2、3…(n-1) d f 0 一电子层中L值越小,该电子亚层的能级越低。 3、磁量子数(m)代表原子轨道在空间的取向。 每一个m值代表一个具有一定空间取向的原子轨道,m的总取值数即、L相同的原 子轨道(叫简并轨道)的数目。 0、±1 2 4、自旋量子数(m)代表电子的自旋,只有两个取值,士1/2。 例写出第M层电子的各量子数的取值及相应原子轨道符号 解答如下:
工程化学教案 第 五章 3 λ、v 是波长与频率,属于波的性质。 二、几率、几率密度与电子云. 原子中的电子高速运动,它的运动无确定的轨道,但原子中的电子在核外出现的机会 在原子核外的分布还是有规律的。核外空间某些区域电子出现的几率较大,而一些区域则出 现的几率较小。 电子在原子核外空间某处单位体积内出现的几率称为几率密度。 电子云则是用密度不同的小黑点来表示电子在空间单位体积内出现的机会即几率密度 的相对大小,黑点较密处,表示电子出现的几率密度较大,黑点较稀处,表示电子出现的几 率密度较小。 三、核外电子运动状态的描述-----薛定谔方程---波函数ψ---三个量子数 炮弹在空中飞行的运动状态,可以用弹道方程来描述,弹道方程的每一组合理解 亦即弹道函数的每一个值,就表示炮弹运动的一种状态,与此类似,电子的运动也用相应的 方程---亦即薛定谔方程(见书 P204)来描述,它是描述核外电子运动状态的基本方程,是 一个关于空间坐标的二阶线性微分方程和关于时间的一阶微分方程,方程的每一组合理解亦 即波函数ψ及其对应的能量 E 就表示了原子中电子的一种可能运动状态,是粒子坐标(空 间位置)的函数,波函数进一步求解的结果是三个量子数,再加上电子自旋量子数总共四个 量子数一起决定电子的运动状态。 核外电子运动状态的描述----薛定谔方程----波函数ψ----三个量子数(n,l,m,n 为主 量子数,ɭ为角量子数,m 为磁量子数)。 n l m ms 决定电子运动状态 决定原子轨道 波函数俗称原子轨道 ⚫ 描述核外电子运动状态的四个量子数 1、主量子数(n) 代表电子层,主量子数为 n,表示第 n 层电子层。是电子能量的 主要决定因素。n 可取正整数即 n = 1、2、3……n。 K L M N …… n 1 2 3 4 第一层 第二层 第三层 第四层 n 值越大,电子层越远离原子核,其能级越高。 2、 角量子数(ɭ) 代表电子亚层,是电子能量的次要决定因素,决定原子轨道的形状。 ɭ取 0、1、2、3……(n-1) s p d f ɭ 0 1 2 3 同一电子层中 ɭ 值越小,该电子亚层的能级越低。 3、 磁量子数(m) 代表原子轨道在空间的取向。 每一个 m 值代表一个具有一定空间取向的原子轨道,m 的总取值数即 n、ɭ 相同的原 子轨道(叫简并轨道)的数目。 m = 0、±1、±2、……±ɭ 4、 自旋量子数(ms) 代表电子的自旋,只有两个取值,±1/2。 例 写出第 M 层电子的各量子数的取值及相应原子轨道符号 解答如下:
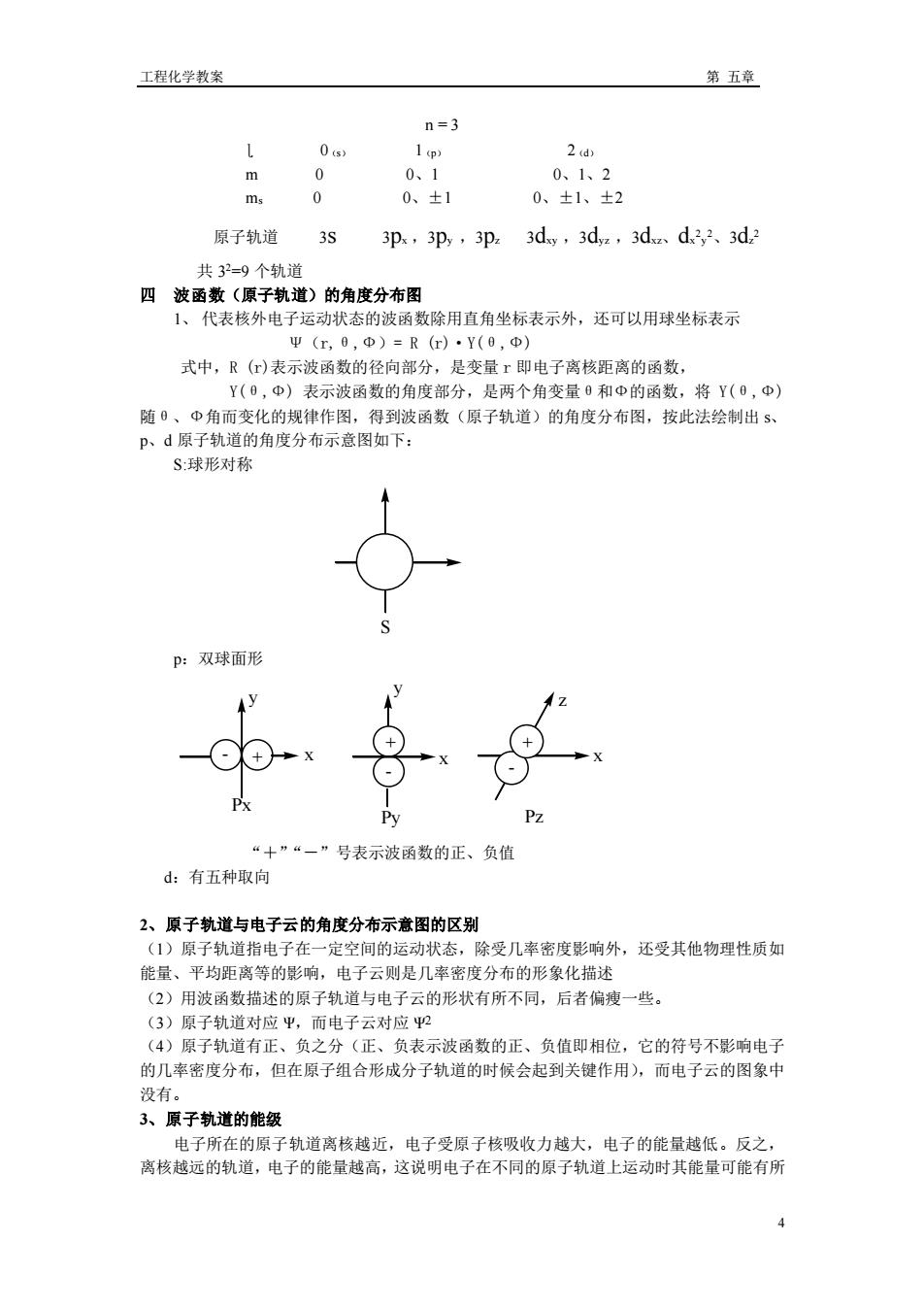
工程化学教案 第五章 n=3 1 2 d) m 、 0、1、2 ms 0 0、±1 0、±1、±2 原子轨道 3S 3p,3p,3p 3dy,3d.,3d、d3,2、3d 共3=9个轨道 四波函数(原子轨道)的角度分布图 1、代表核外电子运动状态的波函数除用直角坐标表示外,还可以用球坐标表示 Ψ(m,8,Φ)=R(r)·Y(8,Φ) 式中,R()表示波函数的径向部分,是变量r即电子离核距离的函数, Y(0,中)表示波函数的角度部分,是两个角变量0和中的函数,将Y(0,中) 随、Φ角而变化的规律作图,得到波函数(原子轨道)的角度分布图,按此法绘制出5 P、d原子轨道的角度分布示意图如下 S:球形对称 p:双球面形 ”“一”号表示波函数的正、负值 d:有五种取向 2、原子轨道与电子云的角度分布示意图的区别 1)原 子轨道指电子在 一定空间的运动状态 除受几率密度影响外,还受其他物理性质如 能量、平均距离等的影响,电子云则是几率密度分布的形象化描述 (2)用波函数描述的原子轨道与电子云的形状有所不同,后者偏瘦一些。 (3)原子轨道对应甲,而电子云对应2 (4)原子轨道有正、负之分(正、负表示波函数的正、负值即相位,它的符号不影响电子 的几率密度分布,但在原子组合形成分子轨道的时候会起到关键作用),而电子云的图象中 没有 3、原子轨道的能级 电子所在的原子轨道离核越近,电子受原子核吸收力越大,电子的能量越低。反之, 离核越远的轨道,电子的能量越高,这说明电子在不同的原子轨道上运动时其能量可能有所 4
工程化学教案 第 五章 4 n = 3 ɭ 0(s) 1(p) 2(d) m 0 0、1 0、1、2 ms 0 0、±1 0、±1、±2 原子轨道 3s 3px ,3py ,3pz 3dxy ,3dyz ,3dxz、dx 2 y 2、3dz 2 共 3 2=9 个轨道 四 波函数(原子轨道)的角度分布图 1、 代表核外电子运动状态的波函数除用直角坐标表示外,还可以用球坐标表示 Ψ(r,θ,Ф)= R (r)·Y(θ,Ф) 式中,R (r)表示波函数的径向部分,是变量 r 即电子离核距离的函数, Y(θ,Ф) 表示波函数的角度部分,是两个角变量θ和Ф的函数,将 Y(θ,Ф) 随θ、Ф角而变化的规律作图,得到波函数(原子轨道)的角度分布图,按此法绘制出 s、 p、d 原子轨道的角度分布示意图如下: S:球形对称 S p:双球面形 - + + - + - + - Px Py Pz x y z x y x “+”“-”号表示波函数的正、负值 d:有五种取向 2、原子轨道与电子云的角度分布示意图的区别 (1)原子轨道指电子在一定空间的运动状态,除受几率密度影响外,还受其他物理性质如 能量、平均距离等的影响,电子云则是几率密度分布的形象化描述 (2)用波函数描述的原子轨道与电子云的形状有所不同,后者偏瘦一些。 (3)原子轨道对应 Ψ,而电子云对应 Ψ2 (4)原子轨道有正、负之分(正、负表示波函数的正、负值即相位,它的符号不影响电子 的几率密度分布,但在原子组合形成分子轨道的时候会起到关键作用),而电子云的图象中 没有。 3、原子轨道的能级 电子所在的原子轨道离核越近,电子受原子核吸收力越大,电子的能量越低。反之, 离核越远的轨道,电子的能量越高,这说明电子在不同的原子轨道上运动时其能量可能有所

工程化学教案 第五章 不同。原子中电子所处的不同能量状态称原子轨道的能级。 根据原子轨道能级的相对高低,可划分为若干个电子层,K、L、M、N、O、P、Q 电子层又可以划分为若干个电子亚层,如s、p、d、f等。每个电子亚层包含若干个原 子轨 原子轨道的能级可以通过光谱实验确定,也可以应用薛定谔方程求得。原子轨道的能 级与其所在电子的电子层及电子亚层有关,还与原子序数有关。 ELE.EECE<ELCEM<ELEsCEECEACEs 规则E:np B、同一电子层不同亚层:ns<np<nd<nf. C、同一亚层内各原子轨道能级相同,称为简并轨道。 D、原子轨道能级随原子序数增大而降低。 结果使其所在的 了某些轨道能级出现交错现象。 第二节多电子原子结构和元素周期律 排布原理 1、泡利原理每一个原子轨道中,最多只能容纳2个自旋相反的电子。 如:B(5) 电子排布式:1s22s22p 泡利原理的重要意义在于,它解决了每一个原子轨道以及各电子层中可容纳的电子数 问题 2、能量最低原理 多申子原子处干基态时,在不违反泡利原理的前提下,核外申子一般是分布在能量较低 的轨道上,以使原子处于能量最低的稳定状态。它解决了或1值不同的轨道中,电子在 各轨道中填充的先后顺序问题。 3、洪特规则 ●基态原子中,同一电子亚层上,电子尽可能单独分布在不同的轨道上,且自旋方向相同 ● 等价轨道在全充满、半充满或全空状态更稳定 它解决了、1值相同的轨道(简并轨道)中电子的分布规律 二、 基态原子核外电子的排布 1、电子排布式 多电子原子核外电子分布的表达式叫做电子排布式(电子分布式)也即电子组态:用符 号(如1s、2印)表示出所有被占轨道,将每个轨道中填充的电子数标注在该轨道符号的右 上角 如: 152s2 2p 3s Ne1o 1s 2s2 2p5 厂最外层最多填充8个 (1)规律 次外层最多填充18个 若只有一层,最多填充2个电子。 一倒数第三层最多为32 (2)价层电子构型即外围电子构型是指价层(指价电子所在的电子亚层)的电子排布式 注意,价层中的电子非一定全是价电子。如:Ag,价层电子标型为4d5s,Ag只有 +1、+2、+3。可见,4d亚层中的10e并非全是价电子。 2、轨道表示式 5
工程化学教案 第 五章 5 不同。原子中电子所处的不同能量状态称原子轨道的能级。 根据原子轨道能级的相对高低,可划分为若干个电子层,K、L、M、N、O、P、Q…. 同一电子层又可以划分为若干个电子亚层,如 s、p、d、f 等。每个电子亚层包含若干个原 子轨道。 原子轨道的能级可以通过光谱实验确定,也可以应用薛定谔方程求得。原子轨道的能 级与其所在电子的电子层及电子亚层有关, 还与原子序数有关。 E1s<E2s<E2p<E3s<E3p<E4s<E4d<E4p<E5s<E5p<E6s<E4f<E5d 规则 E:np>(n-1)d>(n-2)f>ns A、不同电子层能级相对高低 K<L<M<N… B、同一电子层不同亚层:ns<np<nd<nf… C、同一亚层内各原子轨道能级相同,称为简并轨道。 D、原子轨道能级随原子序数增大而降低。 其原因在于原子序数增大亦即核电荷数增大,核对电子的吸引力增强,电子向核靠近的 结果使其所在轨道能级降低。另一方面,由于各原子轨道能级下降的幅度不完全相同,造成 了某些轨道能级出现交错现象。 第二节 多电子原子结构和元素周期律 一、 排布原理 1、泡利原理 每一个原子轨道中,最多只能容纳 2 个自旋相反的电子。 如:B(5), 电子排布式:1s2 2s2 2p1 泡利原理的重要意义在于,它解决了每一个原子轨道以及各电子层中可容纳的电子数 问题 2、能量最低原理 多电子原子处于基态时,在不违反泡利原理的前提下,核外电子一般是分布在能量较低 的轨道上,以使原子处于能量最低的稳定状态。它解决了 n 或 l 值不同的轨道中,电子在 各轨道中填充的先后顺序问题。 3、洪特规则 ⚫ 基态原子中,同一电子亚层上,电子尽可能单独分布在不同的轨道上,且自旋方向相同 ⚫ 等价轨道在全充满、半充满或全空状态更稳定。 它解决了 n、l 值相同的轨道(简并轨道)中电子的分布规律。 二、 基态原子核外电子的排布 1、 电子排布式 多电子原子核外电子分布的表达式叫做电子排布式(电子分布式)也即电子组态:用符 号(如 1s、2p)表示出所有被占轨道,将每个轨道中填充的电子数标注在该轨道符号的右 上角。 如: Na11 1s2 2s2 2p6 3s1 Ne10 1s2 2s2 2p6 最外层最多填充 8 个 (1)规律 次外层最多填充 18 个 若只有一层,最多填充 2 个电子。 倒数第三层最多为 32 (2)价层电子构型即外围电子构型是指价层(指价电子所在的电子亚层)的电子排布式。 注意,价层中的电子非一定全是价电子。如:Ag,价层电子标型为 4d105s1,Ag 只有 +1、+2、+3。可见,4d 亚层中的 10e 并非全是价电子。 2、 轨道表示式