
化学反应速率 实验原理 故所求的过二硫酸铵[NH4)2S2Og和碘化钾 K①反应速度可表示为 △(S2O) 2△t =k(S,Og)m.(I)” 固定S20g2-离子的浓度,改变离子浓度,根据比较 离子在不同浓度下的反应时间△t,即可求得。 固定离子的浓度,改变S20.2-离子的浓度,比较 S20g2-在不同浓度下的反应时间△t,则可求得m
化学反应速率 二、实验原理 故所求的过二硫酸铵[(NH4 )2S2O8 ]和碘化钾 (KI)反应速度可表示为 m n k S O I t S O v ( ) ( ) 2 ( ) 2 2 8 2 2 3 − − − = = 固定S2O8 2-离子的浓度,改变I -离子浓度,根据比较 I -离子在不同浓度下的反应时间△t,即可求得n。 固定I -离子的浓度,改变S2O8 2-离子的浓度,比较 S2O8 2-在不同浓度下的反应时间△t,则可求得m

化学反应速率 三、仪器与试剂 恒温水浴 量筒(10mL、25mL) 温度计 秒表 烧杯(100mL) 0.02moL1CuN03)20.20moL1KI0.2%淀粉溶液 0.20molL-KNO 0.20mol-L-1(NH4)2S2Os 0.01moL-1Na2S203 0.20moL-1NH4)2S04
化学反应速率 三、仪器与试剂 恒温水浴 量筒(10mL、25mL) 温度计 秒表 烧杯(100mL) 0.02 mol·L-1Cu(NO3 )2 0.20mol·L-1KI 0.2%淀粉溶液 0.20mol·L-1KNO3 0.20mol·L-1 (NH4 )2S2O8 0.01mol·L-1Na2S2O3 0.20mol·L-1 (NH4 )2SO4

化学反应速率 四、实验步骤 1、 浓度对化学反应速率的影响 在室温下,用3个烧杯(贴上标签,以免混淆)分别量 取0.20moL-1KI溶液20mL、0.01molL-1Na2S203溶液 8.0mL和0.2%淀粉溶液4.0mL,均倒入100mL干燥洁净 的的烧杯中,混合均匀。再用另一烧杯(贴上标签)量 取0.20molL-1NH4)2S20g溶液20mL,迅速倒入烧杯中, 同时按动秒表,并不断搅拌,仔细观察。当溶液刚出现 蓝色时,立即按停秒表,记录反应时间和室温
化学反应速率 四、实验步骤 1、浓度对化学反应速率的影响 在室温下,用3个烧杯(贴上标签,以免混淆)分别量 取0.20mol·L-1KI溶液20mL、0.01mol·L-1Na2S2O3溶液 8.0mL和0.2%淀粉溶液4.0mL,均倒入100mL干燥洁净 的的烧杯中,混合均匀。再用另一烧杯(贴上标签)量 取0.20mol·L-1(NH4 )2S2O8溶液20mL,迅速倒入烧杯中, 同时按动秒表,并不断搅拌,仔细观察。当溶液刚出现 蓝色时,立即按停秒表,记录反应时间和室温

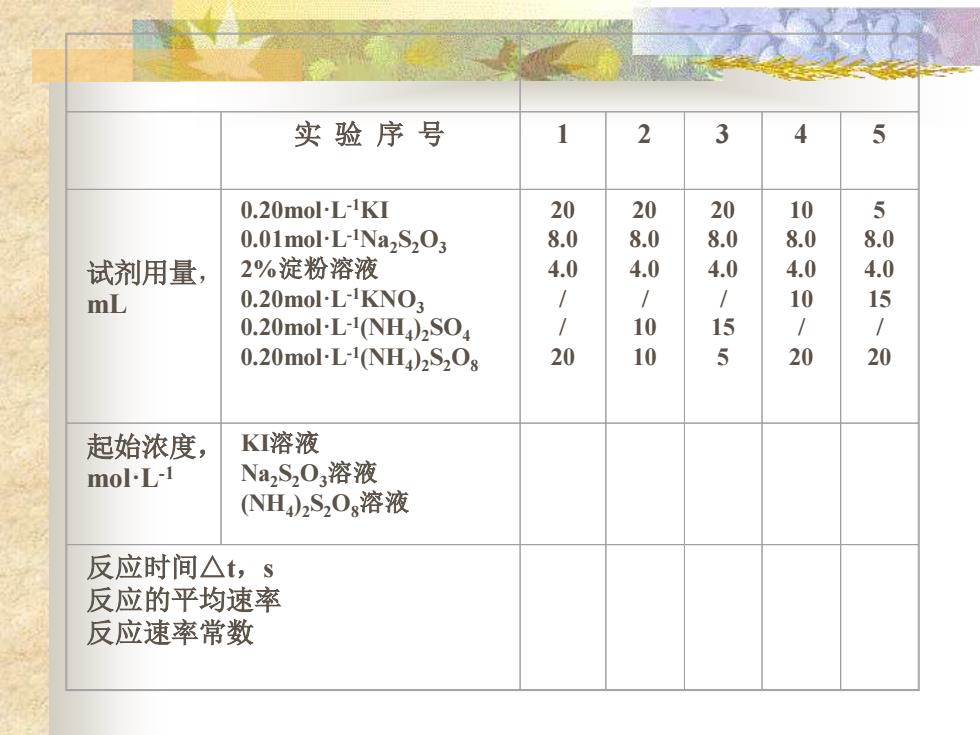
化学反应速率 四、实验步骤 1、 浓度对化学反应速率的影响 用同样的方法按照下表的用量进行另外4次实验。为了 使每次实验中溶液的离子强度和总体积保持不变,可分 别用0.20moL1KN03溶液和0.20molL1(NH4)2S04溶 液补足
化学反应速率 四、实验步骤 1、浓度对化学反应速率的影响 用同样的方法按照下表的用量进行另外4次实验。为了 使每次实验中溶液的离子强度和总体积保持不变,可分 别用0.20mol·L-1KNO3溶液和0.20mol·L-1 (NH4)2SO4溶 液补足
实验序号 2 3 5 0.20mol-L-KI 20 20 20 10 0.01mol-L-INa2S2O3 8.0 8.0 0 8.0 8.0 试剂用量, 2%淀粉溶液 4.0 4.0 4 4.0 mL 0.20moL-1KN03 /10 /15 10 15 0.20mol-L-1(NH)2SO 0.20mol-L-1(NH)2S2Os 20 0 /20 0 起始浓度, KI溶液 mol.L-1 Na2S203溶液 NH4)2S2Og溶液 反应时间△t,s 反应的平均速率 反应速率常数
实 验 序 号 1 2 3 4 5 试剂用量, mL 0.20mol·L-1KI 0.01mol·L-1Na2S2O3 2%淀粉溶液 0.20mol·L-1KNO3 0.20mol·L-1 (NH4 )2SO4 0.20mol·L-1 (NH4 )2S2O8 20 8.0 4.0 / / 20 20 8.0 4.0 / 10 10 20 8.0 4.0 / 15 5 10 8.0 4.0 10 / 20 5 8.0 4.0 15 / 20 起始浓度, mol·L-1 KI溶液 Na2S2O3溶液 (NH4 )2S2O8溶液 反应时间△t,s 反应的平均速率 反应速率常数