
氢原子光谱特征: ·不连续光谱,即线状光谱 ·其频率具有一定的规律 经验公式: 无机化学电子 =32×10分-s n=3,4,5,6 式中2,n,3.289×1015各代表什么意义? 闲
• 不连续光谱,即线状光谱 • 其频率具有一定的规律 1 2 2 1 5 )s 1 2 1 3.289 10 ( − = − n v n= 3,4,5,6 式中 2,n,3.289×1015各代表什么意义? 经验公式: 氢原子光谱特征:

8.1.3 Bohr原子结构理论 Plank量子论(1900年): 微观领域能量不连续。 Einstein光子论(1903年): 光子能量与光的频率成正比 无机化学电子教 E=hy E一光子的能量 y一光的频率 h—Planck常量,h=6.626×10-34Js
8.1.3 Bohr原子结构理论 Plank量子论(1900年): 微观领域能量不连续。 Einstein光子论(1903年): 光子能量与光的频率成正比 E=hν E—光子的能量 ν—光的频率 h—Planck常量, h =6.626×10-34J·s

Bohr理论(三点假设): ①核外电子只能在有确定半径和能量的轨 道上运动,且不辐射能量; ②通常,电子处在离核最近的轨道上,能 量最低一基态;原子获得能量后,电子被 激发到高能量轨道上,原子处于激发态: 无机化学电子教 ③从激发态回到基态释放光能,光的频率 取决于轨道间的能量差。 hv=E2-E E:轨道能量 E2-E v= h
Bohr理论(三点假设): ①核外电子只能在有确定半径和能量的轨 道上运动,且不辐射能量; ②通常,电子处在离核最近的轨道上,能 量最低——基态;原子获得能量后,电子被 激发到高能量轨道上,原子处于激发态; ③从激发态回到基态释放光能,光的频率 取决于轨道间的能量差。 h E E h E E 2 1 2 1 − = = − E:轨道能量
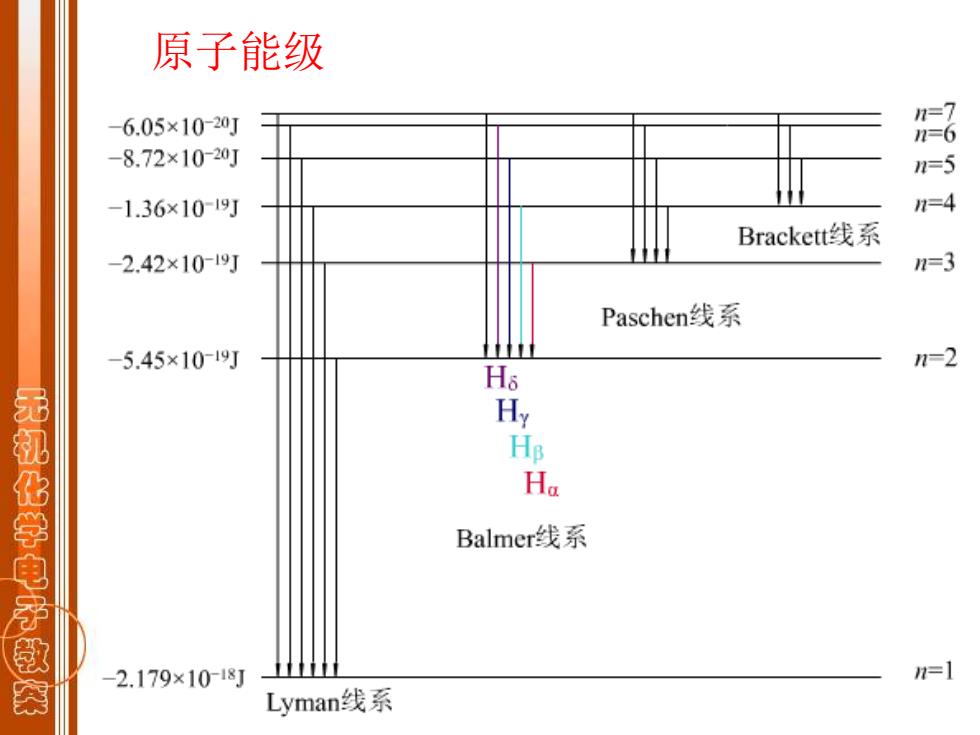
原子能级 -6.05×10-20J -8.72×10-20J -1.36×1019J Brackett线系 -2.42×10-19J n=3 Paschen线系 -5.45×1019J n-2 H 无机化学电子款 Ha Balmer线系 -2.179×10-18J 1=1 Lyman线系
原子能级

Balmer线系 =328910 n=3红(H) n=4青(Hg) n=5蓝紫(H,) 无机化学电子款 n=6紫(H,) 其它线系 =3289×105(- 1 )s-1 n2>n1
1 2 2 1 5 )s 1 2 1 3.289 10 ( − = − n v n = 3 红(Hα) n = 4 青(Hβ ) n = 5 蓝紫 ( Hγ ) n = 6 紫(Hδ ) Balmer线系 其它线系 -1 2 2 2 1 15 )s 1 1 3.289 10 ( n n v = − n2 n1