
第五章一 酸碱平衡 §5.1酸碱质子理论概达 ק5.2水的解高年衡和陪液的pH ק5.3弱酸、弱碱的解离平衡 ק5.4冲陪液 §5.5酸碱指示剂 ק5.6酸碱电子理论 ק5.7 配位化合物 ק5.8 配位反应与配位平衡 返回
第五章 酸碱平衡 § 5.7 配位化合物 § 5.6 酸碱电子理论 § 5.5 酸碱指示剂 § 5.4 缓冲溶液 § 5.3 弱酸、弱碱的解离平衡 § 5.2 水的解离平衡和溶液的pH § 5.1 酸碱质子理论概述 § 5.8 配位反应与配位平衡

§5.1酸碱质子理论桡述 *5.1.1历史回顾 °5.1.2i 酸碱质子理论的基本概念 5.1.3 酸和碱的相对强弱
§ 5.1 酸碱质子理论概述 5.1.3 酸和碱的相对强弱 5.1.2 酸碱质子理论的基本概念 *5.1.1 历史回顾

5.1.2 酸碱质子理论的基本概念 酸:凡是能释放出质子(H+)的任何 分子或离子。 (质子的给予体) 碱:凡是能与质子(H+)结合的分子 无机化学电子教菜 或离子。 (质子的接受体)
酸:凡是能释放出质子(H+)的任何 分子或离子。 (质子的给予体) 碱:凡是能与质子(H+)结合的分子 或离子。 (质子的接受体) 5.1.2 酸碱质子理论的基本概念
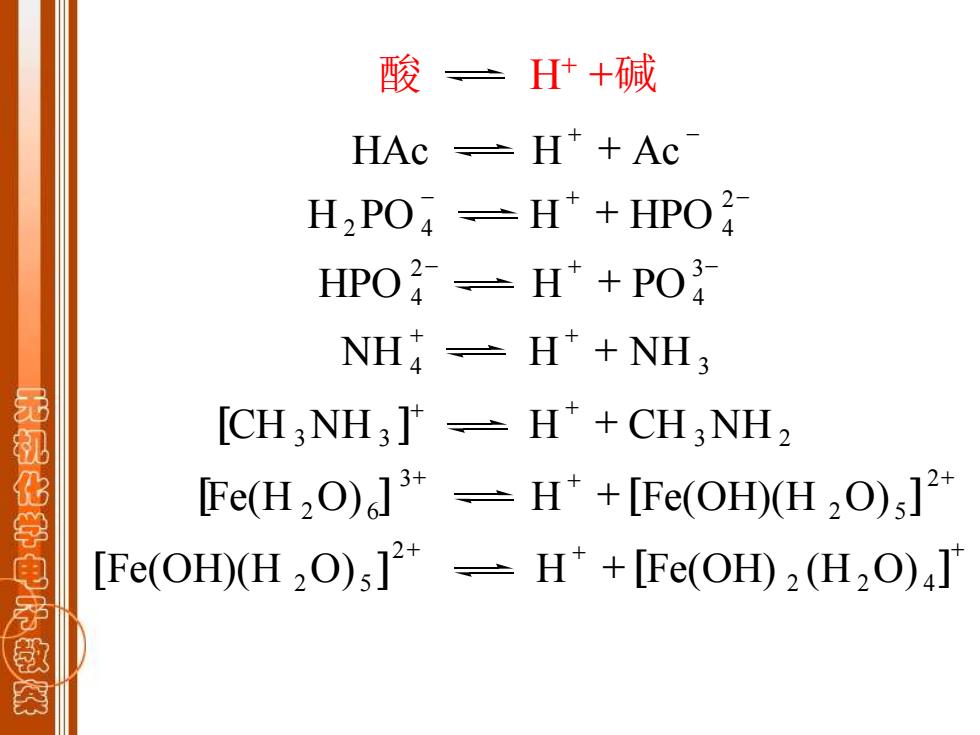
酸三】 H什+碱 HAc =H*+Ac H2PO =H*+HPO2 HPO子=H+PO NH-H*+NH3 无礼化学电子 [CH:NH3]*-H*+CH:NH2 Fe(H2O)]*-H*+[Fe(OHD)(H2O);]2* [Fe(OH)(H2O)]2-H*+[Fe(OH)2(H2O)]
酸 H+ +碱 + - HAc H + Ac - + - + 2 H2PO 4 H HPO 4 - + - + 3 4 2 HPO 4 H PO + + + NH 4 H NH 3 [ ] + + + CH 3NH 3 H CH 3NH 2 + + + + 2 2 5 3 [Fe(H 2O) 6 ] H [Fe(OH)(H O) ] + + + + 2 2 4 2 [Fe(OH)(H 2O) 5 ] H [Fe(OH) (H O) ]

酸 H++ 碱 例:HAc的共轭碱是Ac, Ac一的共轭酸是HAc, HAc和Ac为一对共轭酸碱。 两性物质: 无机化学电子教 既能给出质子,又能接受质子的物质。 如:HSO4,[Fe(OH)H,O), HC0,H,O,HS等
例:HAc的共轭碱是Ac- , Ac-的共轭酸是HAc, HAc和Ac-为一对共轭酸碱。 两性物质: 既能给出质子,又能接受质子的物质。 [ ] 等。 如: - - - + HCO ,H O,HS HSO , Fe(OH)(H O) , 3 2 2 4 2 5 酸 H+ + 碱