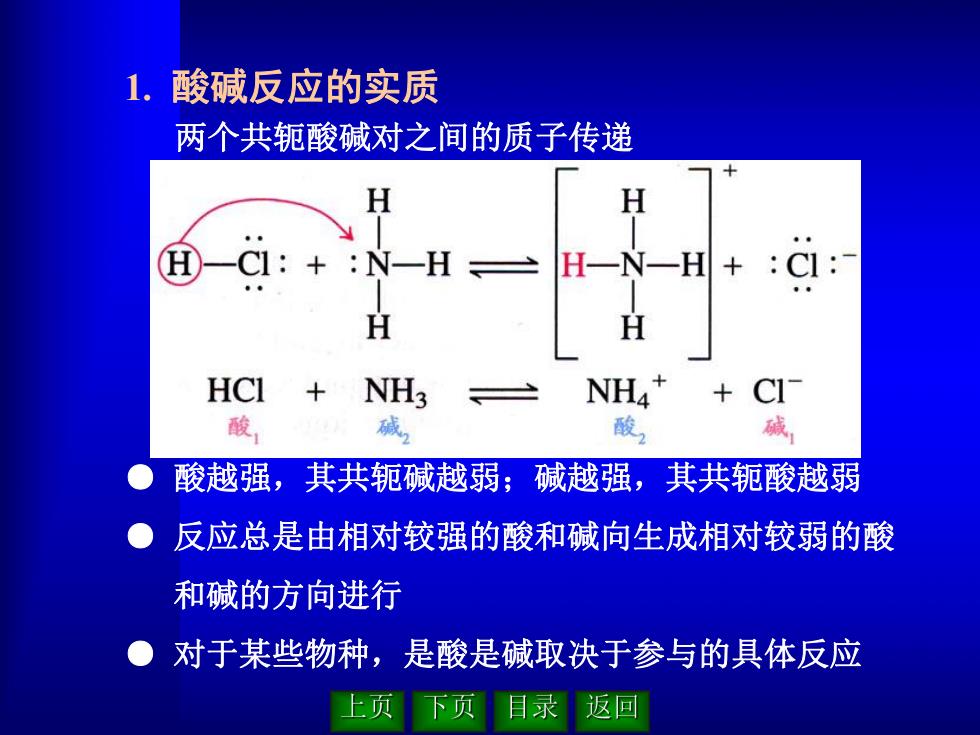
两个共轭酸碱对之间的质子传递 ● 酸越强,其共轭碱越弱;碱越强,其共轭酸越弱 ● 反应总是由相对较强的酸和碱向生成相对较弱的酸 和碱的方向进行 ● 对于某些物种,是酸是碱取决于参与的具体反应 1. 酸碱反应的实质
两个共轭酸碱对之间的质子传递 ● 酸越强,其共轭碱越弱;碱越强,其共轭酸越弱 ● 反应总是由相对较强的酸和碱向生成相对较弱的酸 和碱的方向进行 ● 对于某些物种,是酸是碱取决于参与的具体反应 1. 酸碱反应的实质

2. 酸碱反应的类型 ● 酸和碱的解离反应
2. 酸碱反应的类型 ● 酸和碱的解离反应

● 酸和碱的中和反应 H O (aq) OH (aq) H O(l) H O(l) 3 2 2 H O (aq) NH (aq) NH (aq) H O(l) 3 3 4 2 HAc(aq) OH (aq) H O(l) Ac (aq) 2 H+ H+ H+ ● 盐的水解 [Cu(H O) ] + H O(l) H O (aq) + [Cu(OH)(HO) ] (aq) + 2 3 + 2 3 2+ 2 4 == H+ H+ H+ H O(l) Ac (aq) HAc(aq) OH (aq) 2 NH (aq) H O l H O (aq) NH (aq) 4 2 3 3 ( )
● 酸和碱的中和反应 H O (aq) OH (aq) H O(l) H O(l) 3 2 2 H O (aq) NH (aq) NH (aq) H O(l) 3 3 4 2 HAc(aq) OH (aq) H O(l) Ac (aq) 2 H+ H+ H+ ● 盐的水解 [Cu(H O) ] + H O(l) H O (aq) + [Cu(OH)(HO) ] (aq) + 2 3 + 2 3 2+ 2 4 == H+ H+ H+ H O(l) Ac (aq) HAc(aq) OH (aq) 2 NH (aq) H O l H O (aq) NH (aq) 4 2 3 3 ( )

5.1.3 布朗斯特平衡 布朗斯特酸碱反应可写为如下通式: 显然, 布朗斯特酸碱反应是碱B与碱B’争夺质子的 反应, 碱的强弱影响着酸的强度。 该反应的标准平衡常数 叫酸性常数(Acidity constant), 也叫酸的电离常数(Acid ionization constant): θ Ka { ( )/ } { ( )/ }{ ( )/ } 3 3 3 3 θ a HB mol dm B mol dm H O mol dm c c c K HB + B’ B + HB’ HB(aq) + H2O(l) Bθ(aq) + H3O+(aq)
5.1.3 布朗斯特平衡 布朗斯特酸碱反应可写为如下通式: 显然, 布朗斯特酸碱反应是碱B与碱B’争夺质子的 反应, 碱的强弱影响着酸的强度。 该反应的标准平衡常数 叫酸性常数(Acidity constant), 也叫酸的电离常数(Acid ionization constant): θ Ka { ( )/ } { ( )/ }{ ( )/ } 3 3 3 3 θ a HB mol dm B mol dm H O mol dm c c c K HB + B’ B + HB’ HB(aq) + H2O(l) Bθ(aq) + H3O+(aq)
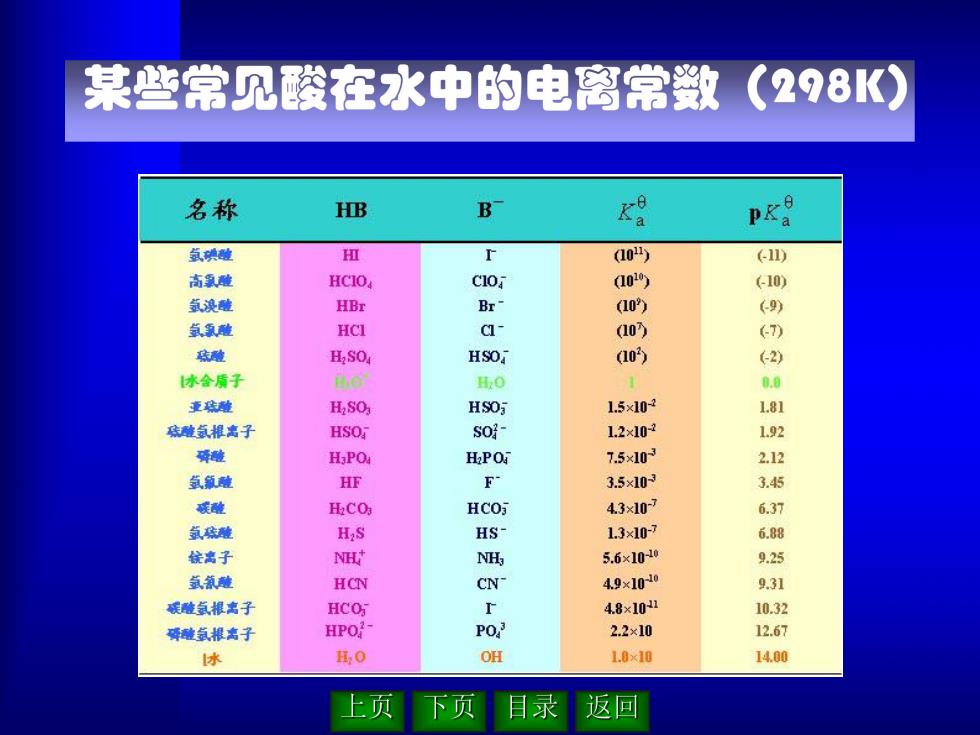
某些常见酸在水中的电离常数(2?8K) 名称 HB B K PKS 氩碘碰 伍 (10) (11) 高氧酸 HCIO C10 (10) (←10) 氛溴罐 HBr Br- (10 (9) 点氛雅 HCI ci- (10 () 底雕 H:SO HSOi (10) 2 休金质子 H:O 1 0.0 重难 H:SO HS0万 1.5×10-2 1.81 雄氢根需子 HSO s0- 1.2×10-2 1.92 磷碰 H:PO HPOi 7.5x103 2.12 氢额难 HF F 3.5×103 3.45 碳能 H.CO HCO 43×10-7 6.37 点珠难 H:S HS 1.3x10-27 6.88 统离子 NH时 NH, 5.6×10-10 9.25 氩氢雕 HCN CN 49x10-0 9.31 碳点根离子 HCO 4.8×10 10.32 磷罐点根名子 HPO- P03 2.2×10 12.67 协 其0 OH 1.9×10 14.00 上页 下页 返▣