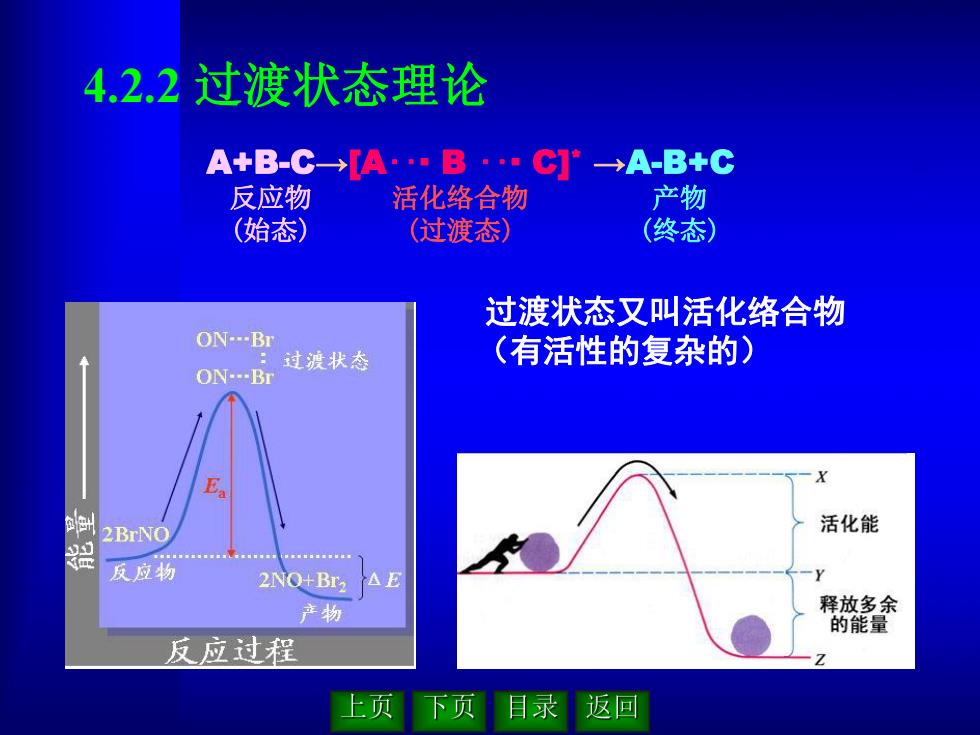
4.2.2 过渡状态理论 过渡状态又叫活化络合物 (有活性的复杂的) A+B-C→[A‥· B ‥· C] * →A-B+C 反应物 (始态) 活化络合物 (过渡态) 产物 (终态)
4.2.2 过渡状态理论 过渡状态又叫活化络合物 (有活性的复杂的) A+B-C→[A‥· B ‥· C] * →A-B+C 反应物 (始态) 活化络合物 (过渡态) 产物 (终态)
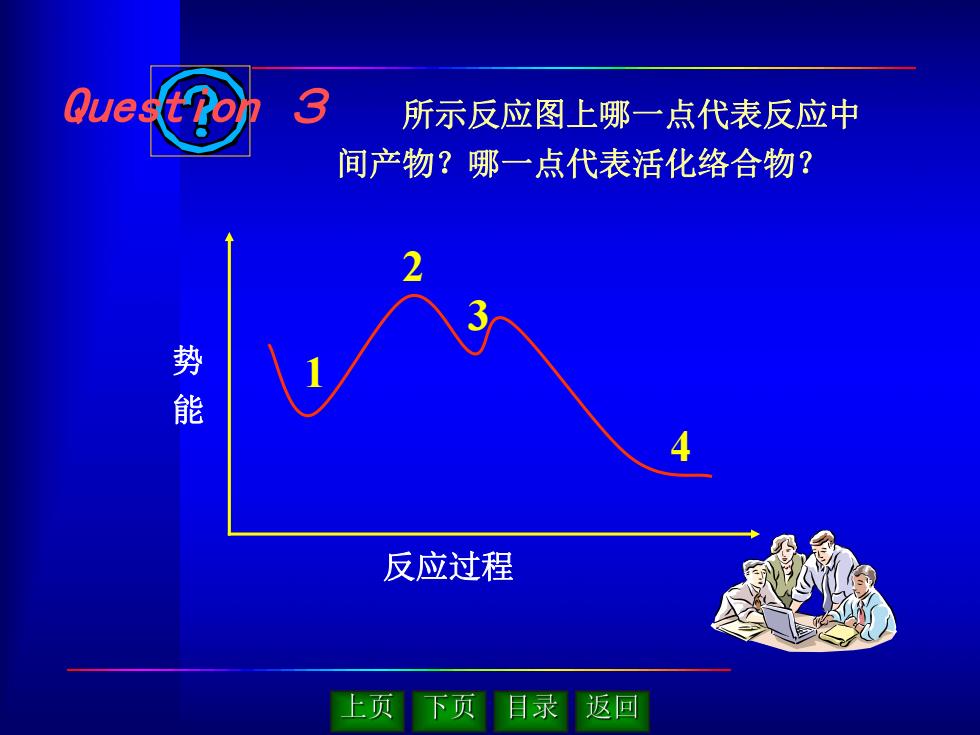
所示反应图上哪一点代表反应中 间产物?哪一点代表活化络合物? 1 2 3 4 势 能 反应过程 Question 3
所示反应图上哪一点代表反应中 间产物?哪一点代表活化络合物? 1 2 3 4 势 能 反应过程 Question 3

定义: k Ea E E * 各种教材给予活化能的定义不同,本课程使用如下 定义,即活化分子的平均动能与分子平均动能之差. 4.2.3 活化能 Ea
定义: k Ea E E * 各种教材给予活化能的定义不同,本课程使用如下 定义,即活化分子的平均动能与分子平均动能之差. 4.2.3 活化能 Ea

1 O3 (g) NO(g) NO2 (g) O2 (g), r 199 6 kJ mol H . ★ 反应物的能量必 须爬过一个能垒 才能转化为产物 ★ 即使是放热反应 (△rH为负值), 外界仍必须提供 最低限度的能量, 这个能量就是 反应的活化能
1 O3 (g) NO(g) NO2 (g) O2 (g), r 199 6 kJ mol H . ★ 反应物的能量必 须爬过一个能垒 才能转化为产物 ★ 即使是放热反应 (△rH为负值), 外界仍必须提供 最低限度的能量, 这个能量就是 反应的活化能

▲ 离子反应和沉淀反应的Ea都很小 一般认为Ea小于63 kJ·mol -1的为快速反应 小于40 kJ·mol -1和大于400 kJ·mol -1的都很难测定出 ▲ 一些反应的Ea ▲ 每一反应的活化能数值各异, 可以通过实验和计算得 到 。活化能越小, 反应速率越快。Ea是动力学参数。 N2(g) + 3H2(g) = 2NH3(g), Ea =175.5 kJ·mol-1 HCl + NaOH → NaCl+H2O, Ea ≈20 kJ·mol-1 2SO2(g) + O2(g) = 2SO3(g), Ea =251 kJ·mol-1
▲ 离子反应和沉淀反应的Ea都很小 一般认为Ea小于63 kJ·mol -1的为快速反应 小于40 kJ·mol -1和大于400 kJ·mol -1的都很难测定出 ▲ 一些反应的Ea ▲ 每一反应的活化能数值各异, 可以通过实验和计算得 到 。活化能越小, 反应速率越快。Ea是动力学参数。 N2(g) + 3H2(g) = 2NH3(g), Ea =175.5 kJ·mol-1 HCl + NaOH → NaCl+H2O, Ea ≈20 kJ·mol-1 2SO2(g) + O2(g) = 2SO3(g), Ea =251 kJ·mol-1