
注意这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势4保持不变。 公式(a)表示有限体系中发生微小的变化: 公式(b)表示在大量的体系中发生了反应进度等于1mol的 变化。这时各物质的浓度基本不变,化学势也保持不变
Xi’an University of Science & Technology 注意这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势 B 保持不变。 公式(a)表示有限体系中发生微小的变化; 公式(b)表示在大量的体系中发生了反应进度等于1 mol的 变化。这时各物质的浓度基本不变,化学势也保持不变
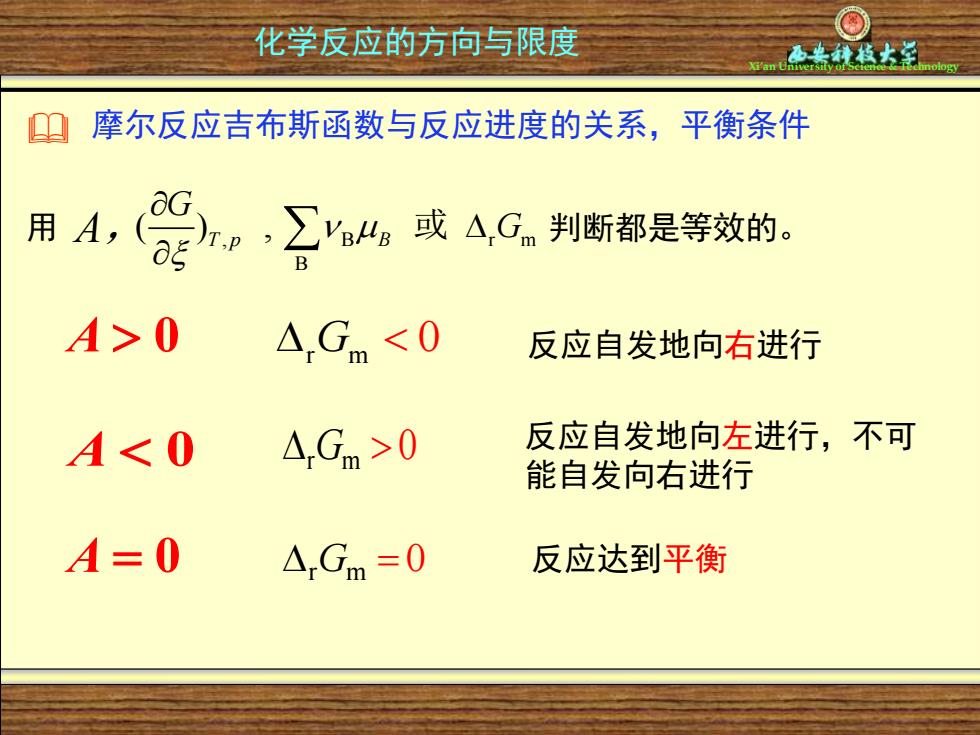
化学反应的方向与限度 9 摩尔反应吉布斯函数与反应进度的关系,平衡条件 用,(9,工山或AG判断都是等效的 A>0 △Gm<0 反应自发地向右进行 A<0 △.Gm>0 反应自发地向左进行,不可 能自发向右进行 A=0 △Gm=0 反应达到平衡
Xi’an University of Science & Technology 化学反应的方向与限度 r m G 0 反应自发地向左进行,不可 能自发向右进行 r m G = 0 反应达到平衡 A 0 r m A 0 G 0 反应自发地向右进行 A = 0 摩尔反应吉布斯函数与反应进度的关系,平衡条件 用 , B r m 判断都是等效的。 B ( ) , T p B G G A, 或
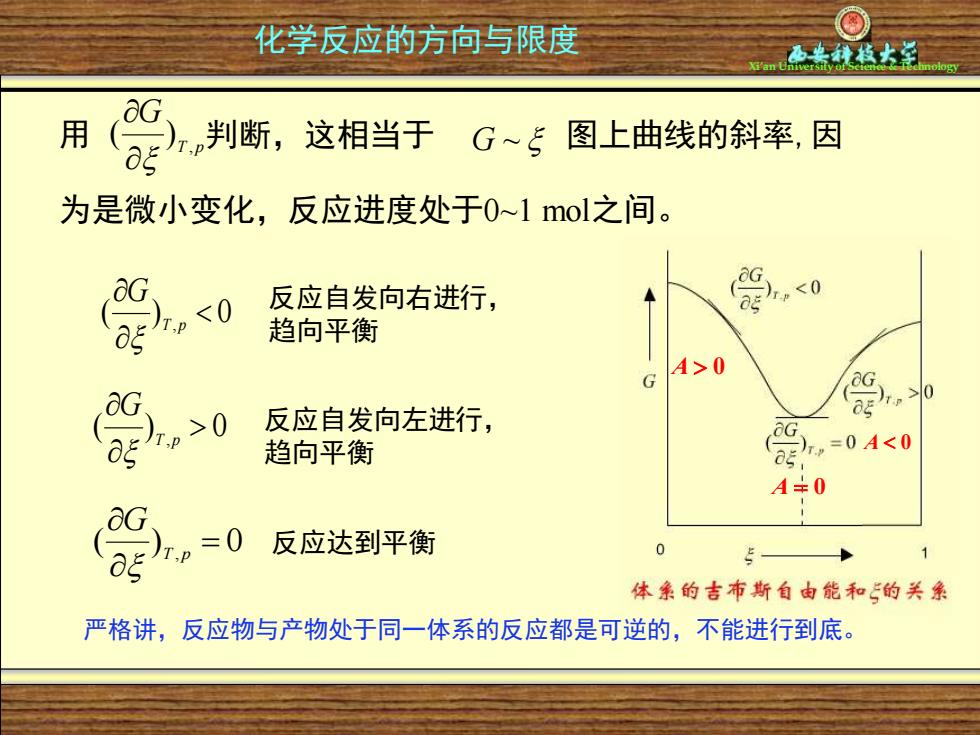
化学反应的方向与限度 用 判断, 这相当于G~5 图上曲线的斜率,因 为是微小变化,反应进度处于0~1mol之间。 0 反应自发向右进行, <0 趋向平衡 A>0 反应自发向左进行, ,0 G 趋向平衡 ,=04<0 A+0 =0 反应达到平衡 0 体象的吉布斯自由能和的关象 严格讲,反应物与产物处于同一体系的反应都是可逆的,不能进行到底
Xi’an University of Science & Technology 用 判断,这相当于 图上曲线的斜率,因 为是微小变化,反应进度处于0~1 mol之间。 T p G , ( ) G ~ ( ) 0 , T p G 反应自发向右进行, 趋向平衡 ( ) 0 , T p G 反应自发向左进行, 趋向平衡 ( ) , = 0 T p G 反应达到平衡 A 0 A 0 A = 0 严格讲,反应物与产物处于同一体系的反应都是可逆的,不能进行到底。 化学反应的方向与限度

化学反应的等温方程 9 理想气体化学反应的等温方程 0=VBB B 4B=u°+RTn(pB/p) 将化学势表示式代入△Gm的计算式,得: A,Gn=∑YB4B B =∑ysg+∑Vr RT Ine(pB/p) B 令:△,G0=∑V哈 △,G%称为化学反应标准摩尔Gibbs自由能变化值, 只是温度的函数
Xi’an University of Science & Technology 将化学势表示式代入 r m G 的计算式,得: r m B B B G 令: = 称为化学反应标准摩尔Gibbs 自由能变化值, 只是温度的函数。 r m G 理想气体化学反应的等温方程 化学反应的等温方程 B B 0 B = ln( / ) B = + RT pB p = + = B B B B B B B r m B B RT p p G ln( / )