
离子一电子法 (3)得失电子数帽等,产生离子方程式 2I-2e-=12 +)1 H202+2Ht+2e-=2H20 H02+2I+2H+=2H0+
(3)得失电子数相等,产生离子方程式 氧化反应: 2I- - 2e- = I2 还原反应: H2O2 + 2H+ + 2e- ==2H2O 离子—电子法 1 2I- - 2e- = I2 1 H2O2 + 2H+ +) + 2e- ==2H2O H2O2 + 2I- + 2H+ =2H2O + I2

例 题 例:用离子-电子法写出KMn04与盐酸反应的离子方程式 (1) MnO4+CI→Cl2+Mn2+ (2) MnO+8H+5e Mn2++4H2O 2C1-2e=Cl2 MnO+8H++5e Mn2++4H2O 十 2 Cl-2e Cl, 2Mn04+16H++10CI=2Mn2++5C12+8H0
(3) 2 MnO4 - + 8H++ 5e = Mn2+ + 4H2O 5 2 Cl - - 2e = Cl2 2MnO4 - + 16H++ 10Cl- = 2Mn2+ +5Cl2+8H2O (1) MnO4 - + Cl- → Cl2 + Mn2+ (2) MnO4 - + 8H++ 5e = Mn2+ + 4H2O 2 Cl - - 2e = Cl2 例 题 例:用离子-电子法写出 KMnO4 与盐酸反应的离子方程式 +)

氧化值法 配平原则—在氧化还原反应中,氧化剂氧化值降低的 总数必定等于还原剂氧化值升高的总数。 具体步骤如下: (1)确定产物,写出宋配平的反武 KMnO4+H2S +H2SO-MnSO4+S+K2SO+H2O (2)计算元素氧化值的改变数值 2-7=-5 KMnO+H2S H2SO MnSO+$+K2SO+H2O 0-(-2)=2
配平原则——在氧化还原反应中,氧化剂氧化值降低的 总数必定等于还原剂氧化值升高的总数。 具体步骤如下: (1)确定产物,写出未配平的反应式 氧 化 值 法 (2)计算元素氧化值的改变数值 KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O 2-7=-5 0-(-2)=2

氧化值法 (3)找出晶小变放,使氧化值的升高与降低数值相等。 2-7=-5×2=10 2 KMnO4 +5 H2S H2SO-MnSO +S+K2SO+H2O [0-(-2)=2×5=10 (4)配平各种原子,先配平其它原子,最后写 2KMnO+5H2S+3 H2SO2 MnSO+5S+K2SO4 +8 H2O
(3)找出最小因数,使氧化值的升高与降低数值相等。 (4)配平各种原子,先配平其它原子,最后再配氢氧 氧 化 值 法 ×2=10 ×5=10 KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O 2-7=-5 [0-(-2)=2 2 5 2KMnO4 + 5H2S + H3 2SO4 → MnSO 2 4 + S + K 5 2SO4 + H8 2O
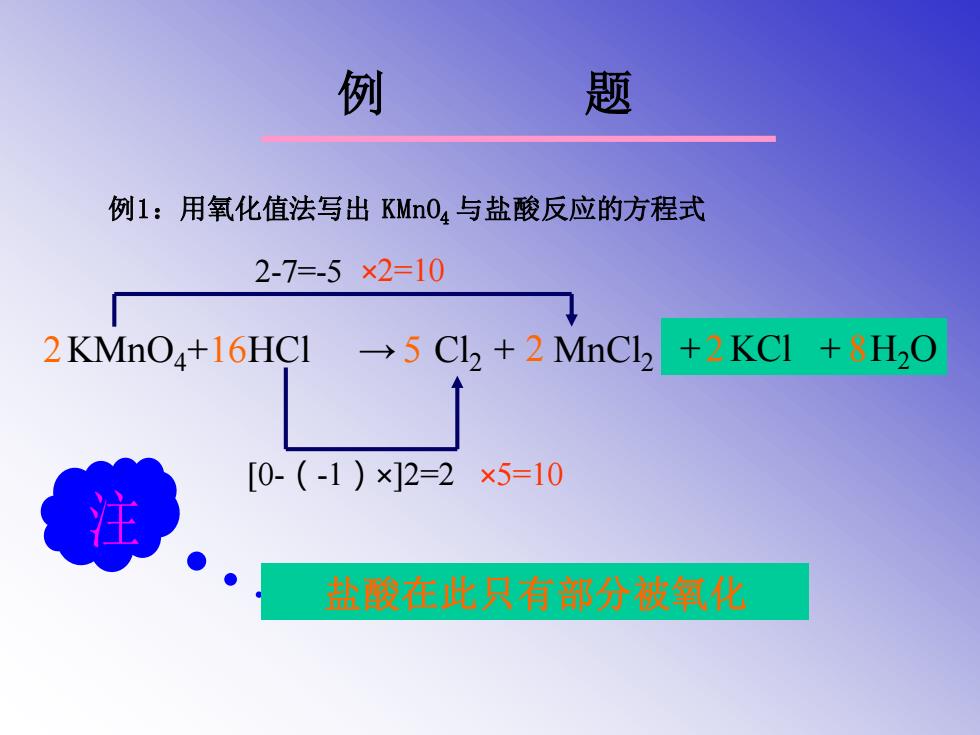
例 题 例1:用氧化值法写出KMn04与盐酸反应的方程式 2-7=-5×2=10 2KMnO4+16HCI 5 Cl2 +2 MnCl2 KCI +8H20 [0-(-1)×]2=2×5=10 注 盐酸在此只有部分被氧化
例 题 例1:用氧化值法写出 KMnO4 与盐酸反应的方程式 KMnO4+ HCl → Cl2 + MnCl2 2-7=-5 ×2=10 [0-(-1)×]2=2 ×5=10 2 16 5 2 + KCl 2 + H8 2O 盐酸在此只有部分被氧化