
4-3配位化合物的结构理论 一、价键理论 价键理论能够说明 (1)配合物的配位数 (2)几何构型, (3)磁矩及反应活性 1.1 配合物中的化学键 内界和外界的结合力 静电力 内界中的化学键 主键 o键 副键 反馈π键、Π键 反馈π键:具有接受电子的空轨道,接受电子的空轨 道又反馈回部分电子给配体
4-3 配位化合物的结构理论 一、价键理论 价键理论能够说明 ⑴ 配合物的配位数 ⑵几何构型, ⑶ 磁矩及反应活性 内界中的化学键 1. 配合物中的化学键 内界和外界的结合力——静电力 主键—— 键 副键—— 反馈键、键 反馈键 :具有接受电子的空轨道, 接受电子的空轨 道又反馈回部分电子给配体

例如:Pt(C,H4)Cl3] C,H,提供π电子,中心Pt(I⑩以dsp轨道接受π电 子,形成的键是σ键,Pt()又反配给C,H反键 π*轨道的dπ*,π键;o一π键 2.外轨型配合物和内轨型配合物 (1)中心体接受电子的两种方式 中心原子用外层轨道接纳配体电子, 例如:[FeF3 sp3dP杂化,八面体构型, 外轨型配合物 3d (2)中心原子用部分内层轨道接纳配体电子, 例如:[CrH2O)6]3+dPsp杂化,八面体构型, 内轨型配合物 3d
例如:[Pt(C2H4 )Cl3 ] – C2H4提供电子,中心Pt(II)以dsp2轨道接受电 子,形成的键是键, Pt(II)又反配给C2H4反键 ﹡轨道的 d- ﹡ ,键; —键 2.外轨型配合物和内轨型配合物 ⑴中心体接受电子的两种方式 中心原子用外层轨道接纳配体电子, 例如:[FeF6 ] 3– sp3d 2杂化, 八面体构型, 外轨型配合物 3d 5 ⑵中心原子用部分内层轨道接纳配体电子, 例如:[Cr(H2O)6 ] 3+ d 2 sp3杂化, 八面体构型, 内轨型配合物 3d 3
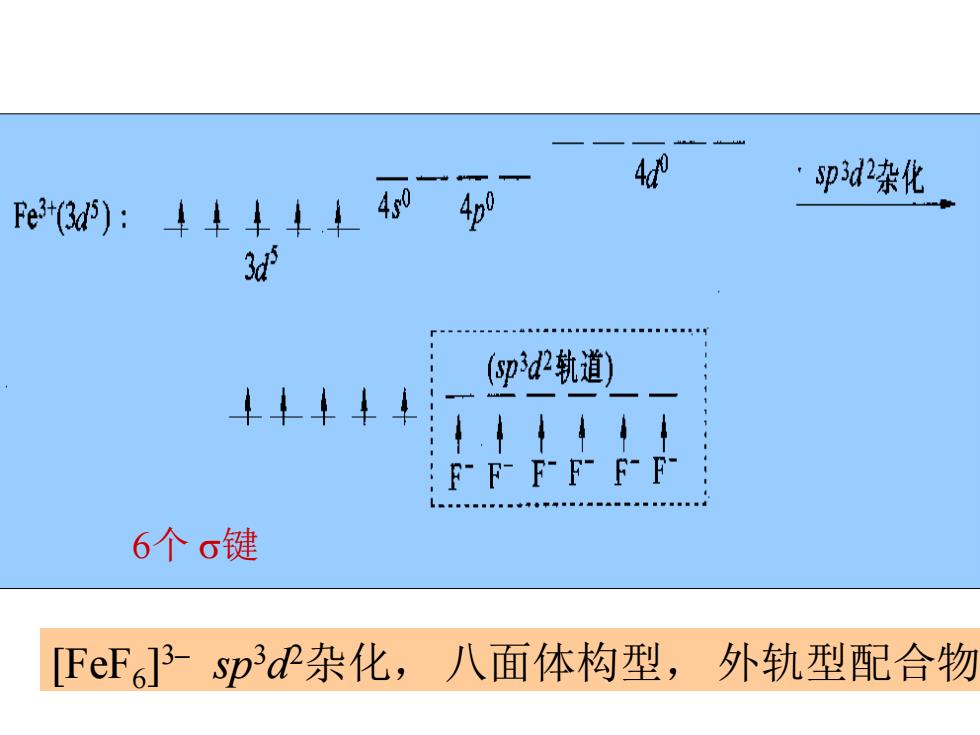
4 pd2染化 Fe3(u):4↓↓↓↓404p 3d spd2轨道) 44↓ F-F-F-F-F-F- 6个6键 [FeF6]3spdP杂化,八面体构型,外轨型配合物
[FeF6 ] 3– sp3d 2杂化, 八面体构型, 外轨型配合物 6个 键
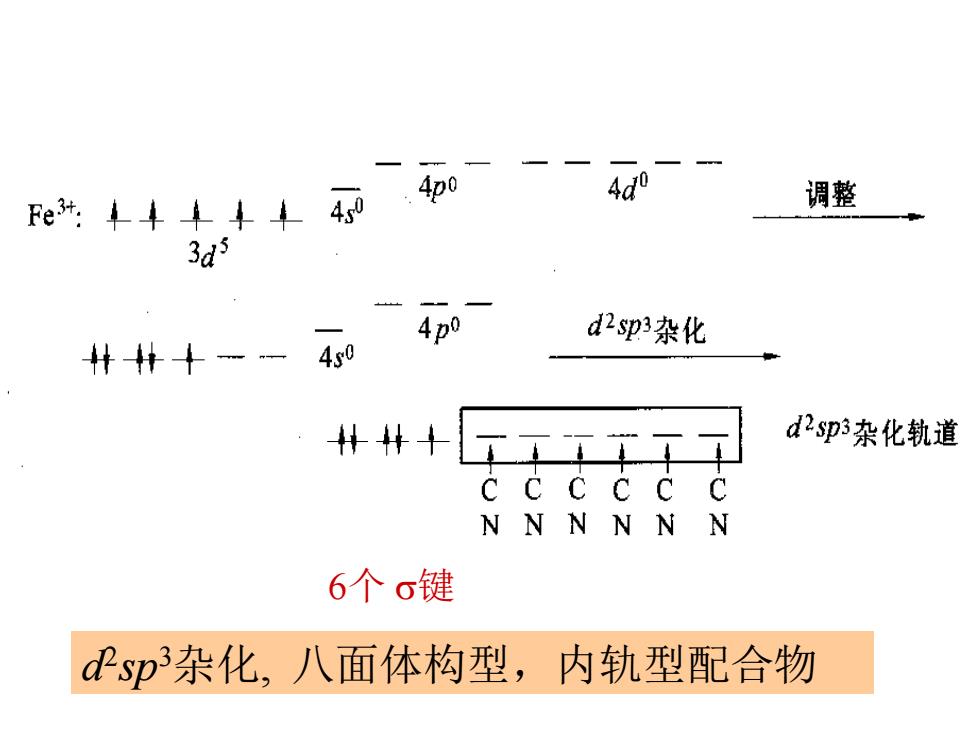
F阳所丰44140 调整 3d3 4p0 d2sp3杂化 -4s0 #4+工工工王工 d2sp3杂化轨道 NNNNN N 6个σ键 Psp杂化,八面体构型,内轨型配合物
d 2 sp3杂化, 八面体构型,内轨型配合物 6个 键

(3)内外轨型取决于 配位体场(主要因素) 中心原子(次要因素) a 强场配体,如CN-CONO2等,易形成内轨型, 弱场配体,如X-、H,O易形成外轨型 (b)中心原子aP型,如Cr3+,有空(n-1)d轨道, (n-1)dns np3易形成内轨型 中心原子d8dl0型,如Fe2+,Ni2+,Zn2+,Cd2+,Cu 无空(n-1)d轨道,(ns)(p)3(nd2易形成外轨型
(3)内外轨型取决于 配位体场(主要因素) 中心原子(次要因素) (a) 强场配体,如CN – CO NO2 –等,易形成内轨型, 弱场配体,如 X – 、H2O易形成外轨型 (b) 中心原子d 3型, 如Cr3+ ,有空(n-1)d轨道, (n-1)d 2 ns np3易形成内轨型 中心原子d 8~ d 10型,如Fe2+, Ni2+,Zn2+, Cd2+, Cu+ 无空(n-1)d轨道,(ns) (np) 3 (nd) 2易形成外轨型