
16-2-2 氮的氢化物 二、氨盐 氨盐一般是无色晶体,易溶于水。NH+离子 半径为143pm接近于和的半径,因此氨盐的性 质类似于碱金属盐类,而且往往与钾盐、铷盐 同晶,并有相似的溶解度。 由于氨的弱碱性,由强酸组成的氨盐其水溶 液显酸性: NH++H2O===NH3H2O+H 因此在任何氨盐溶液中加入强碱并加热,就会放 出氨(NH+的鉴定反应): NH++OH ==NH3 +H2O
16-2-2 氮的氢化物 二、氨盐 氨盐一般是无色晶体,易溶于水。NH4 +离子 半径为143pm接近于和的半径,因此氨盐的性 质类似于碱金属盐类,而且往往与钾盐、铷盐 同晶,并有相似的溶解度。 由于氨的弱碱性,由强酸组成的氨盐其水溶 液显酸性: NH4 + + H2O === NH3·H2O + H+ 因此在任何氨盐溶液中加入强碱并加热,就会放 出氨(NH4 +的鉴定反应): NH4 + + OH- === NH3 + H2O
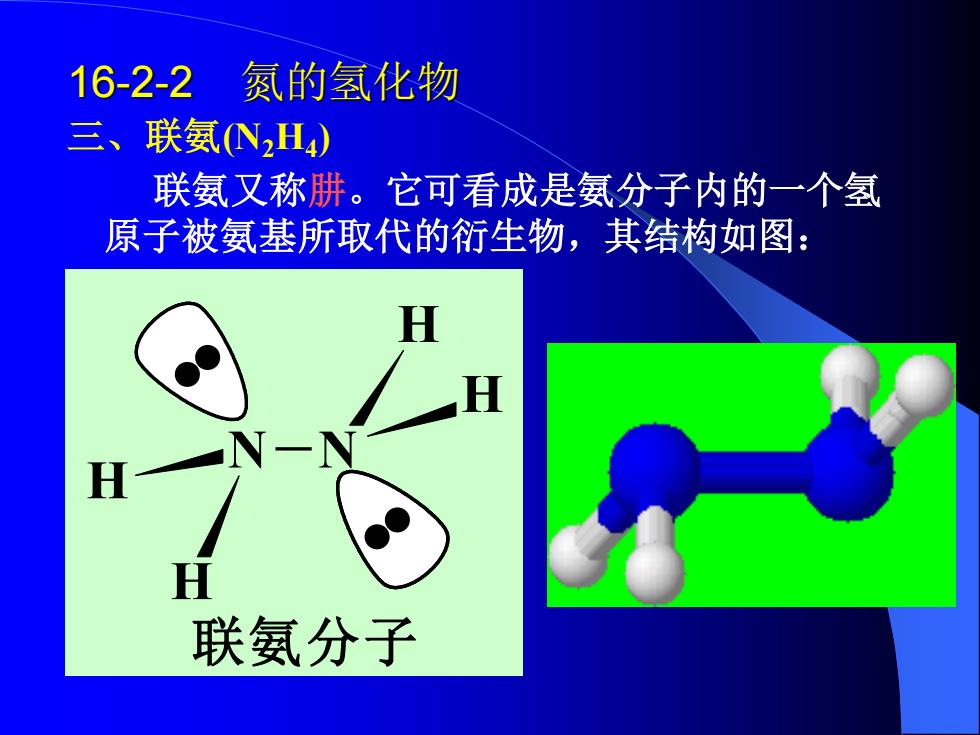
16-2-2 氮的氢化物 三、联氨N2H4) 联氨又称肼。它可看成是氨分子内的一个氢 原子被氨基所取代的衍生物,其结构如图: H 联氨分子
16-2-2 氮的氢化物 三、联氨(N2H4 ) 联氨又称肼。它可看成是氨分子内的一个氢 原子被氨基所取代的衍生物,其结构如图: N N H H H H 联氨分子

16-2-2 氮的氢化物 肼N,H)是以次氯酸钠氧化氨(在氨过量的条件 下),但仅能获得肼的稀溶液。 NaCIO+2NH3===N2H+NaCHHO 联氨分子结构每个氮原子都用sp杂化轨道形成 键。由于两对孤电子对的排斥作用,使两对孤电 子对处于反位,并使N一N键的稳定性降低,因此 N,H4比NH3更不稳定,加热时便发生爆炸性分解 N2H4①)+O2(g)-==N2(g)+2H20) △,H=-624kJ/mol 肼和其某些衍生物燃烧时放热很多,可做为火箭燃料
16-2-2 氮的氢化物 肼(N2H4 )是以次氯酸钠氧化氨(在氨过量的条件 下),但仅能获得肼的稀溶液。 NaClO+2NH3===N2H4+NaCl+H2O 联氨分子结构每个氮原子都用sp3杂化轨道形成 键。由于两对孤电子对的排斥作用,使两对孤电 子对处于反位,并使N—N键的稳定性降低,因此 N2H4比NH3更不稳定,加热时便发生爆炸性分解 N2H4 (l)+O2 (g)===N2 (g)+2H2O(l) rH =-624kJ/mol 肼和其某些衍生物燃烧时放热很多,可做为火箭燃料

16-2-2 氮的氢化物 联氨中每一个N有一孤电子对,可以接受两个 质子而显碱性,是二元弱碱,碱性稍弱于氨。 N2H4+H20===N2H5+OHK1=1.0x10-6(298K N2H+H20==N2H。2+OHK2=9.0×1016(298K 联氨在酸性条件下既是氧化剂又是还原剂,在中 性和碱性溶液中主要做还原剂。能将CuO、IO3、 C2、Br2还原,本身被氧化为N2 4CuO+N21,==2Cu20+N2↑+2H20 2I03+3N,1===2+3N,↑+6H,O 参加反应的氧化剂不同,NH的氧化产物除 N2,还有NH4和HN3 2MnO,+10N2Hs*+6H+==10NH,*+5N21+2Mn2++8H,O N,山+HNO2==HN,+II+21I,O(特殊反应)
16-2-2 氮的氢化物 联氨中每一个N有一孤电子对,可以接受两个 质子而显碱性,是二元弱碱,碱性稍弱于氨。 N2H4+H2O===N2H5 ++OH- K1=1.010-6 (298K) N2H5 ++H2O===N2H6 2++OH- K2=9.010-16(298K) 联氨在酸性条件下既是氧化剂又是还原剂,在中 性和碱性溶液中主要做还原剂。能将CuO、IO3 -、 Cl2、Br2还原,本身被氧化为N2 4CuO+N2H4===2Cu2O+N2↑+2H2O 2IO3 -+3N2H4===2I-+3N2↑+6H2O 参加反应的氧化剂不同,N2H4的氧化产物除了 N2,还有NH4 +和HN3。 2MnO4 -+10N2H5 ++6H+===10NH4 ++5N2↑+2Mn2++8H2O N2H5 ++HNO2===HN3+H++2H2O(特殊反应)

16-2-2 氮的氢化物 四、羟氨NH,OH) 羟氨可看成是氨分子内的一个氢原子被羟基取代的行生 物,N的氧化态是I,纯羟氨是无色固体,熔点305K,不 稳定,在288K以上便分解为NH3、N2和H2O 3NH,OH===NH1+N21+3H,O 4NH,OH=2NH3个+N2O个+3H2O(部分按此式分解) 羟氨易溶于水,其水溶液比较稳定,显弱碱性(比联氨还 弱)。 NH2OH+H20===NH3OH+OHKb=6.6×10-9(298K) 它与酸形成盐,如:NH3OHC1和NH3OH2SO4 羟氨既有还原性又有氧化性,但它主要用作还原剂。羟 氨与联氨作为还原剂的优点,一方面是它们具有强的还 原性,另一方面是它们的氧化产物主要是气体N2,N20, NO),可以脱离反应体系,不会给反应体系带来杂质
16-2-2 氮的氢化物 四、羟氨(NH2OH) 羟氨可看成是氨分子内的一个氢原子被羟基取代的行生 物,N的氧化态是-I,纯羟氨是无色固体,熔点305K,不 稳定,在288K以上便分解为NH3、N2和H2O 3NH2OH===NH3↑+N2↑+3H2O 4NH2OH==2NH3+N2O+3H2O(部分按此式分解) 羟氨易溶于水,其水溶液比较稳定,显弱碱性(比联氨还 弱)。 NH2OH+H2O===NH3OH++OH- Kb=6.610-9 (298K) 它与酸形成盐,如:[NH3OH]Cl和(NH3OH)2SO4。 羟氨既有还原性又有氧化性,但它主要用作还原剂。羟 氨与联氨作为还原剂的优点,一方面是它们具有强的还 原性,另一方面是它们的氧化产物主要是气体(N2,N2O, NO),可以脱离反应体系,不会给反应体系带来杂质