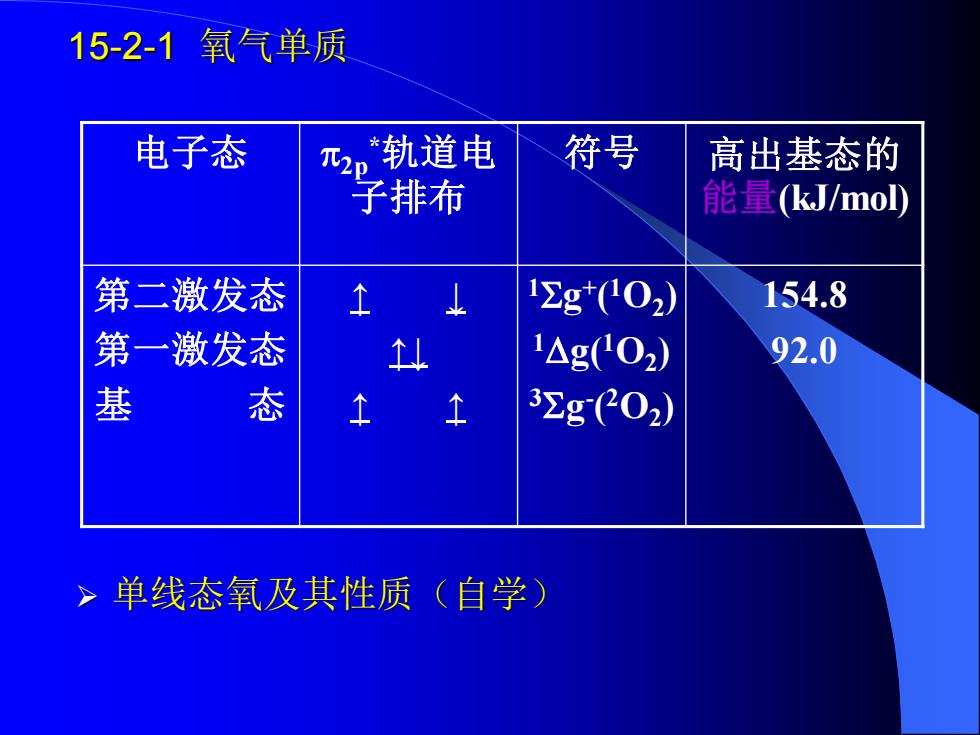
15-2-1氧气单质 电子态 兀2p轨道电 符号 高出基态的 子排布 能量kJ/mol 第二激发态 12g*C02) 154.8 第一激发态 1△g02) 92.0 基 态 32g(02) >单线态氧及其性质(自学)
15-2-1 氧气单质 电子态 2p *轨道电 子排布 符号 高出基态的 能量(kJ/mol) 第二激发态 第一激发态 基 态 ↑ ↓ ↑↓ ↑ ↑ 1g + ( 1O2 ) 1g(1O2 ) 3g - ( 2O2 ) 154.8 92.0 ➢ 单线态氧及其性质(自学)

15-2-2氧化物 大多数非金属氧化物和某些高氧化态的金属氧化物 均显酸性;大多数金属氧化物显碱性;一些金属氧化物 (如A山,03.ZmO)和少数非金属氧化物(如As,0,、 Sb,O。)显两性;中性氧化物有NO、CO等。氧化物酸 碱性的一般规律是: 同周期各元素最高氧化态的氧化物从左到右由碱性一 一两性—酸性 相同氧化态的同族各元素的氧化物从上到下碱性依次 增强 同一元素能形成几种氧化态的氧化物酸性随氧化数的 升高而增强 氧化物还可按其价键特征分为离子型氧化物、共价 型氧化物和过度型氧化物
15-2-2 氧化物 大多数非金属氧化物和某些高氧化态的金属氧化物 均显酸性;大多数金属氧化物显碱性;一些金属氧化物 (如Al2O3、 ZnO )和少数非金属氧化物(如As3O6 、 Sb4O6、)显两性;中性氧化物有NO 、CO等。氧化物酸 碱性的一般规律是: 同周期各元素最高氧化态的氧化物从左到右由碱性— —两性——酸性 相同氧化态的同族各元素的氧化物从上到下碱性依次 增强 同一元素能形成几种氧化态的氧化物酸性随氧化数的 升高而增强 氧化物还可按其价键特征分为离子型氧化物、共价 型氧化物和过度型氧化物

15-2-3臭氧 03与02是由同一种元素组成的不同单质,互称同素异 形体。 O3在地面附近的大气层中含量极少,仅占0.001ppm。在 离地面2040km处有个臭氧层,臭氧浓度高达0.2ppm。 它是氧气吸收太阳的紫外线后形成的。反应为: O2thW2<242nm)=0+0,0+0==03 03+hM2=220-320nm)==0,+0 这两种过程最后达到动态平衡,结果形成了一个浓度 相对稳定的臭氧层。正是这臭氧层吸收了高空紫外线的 强辐射,使地球上的生物免遭伤害。但近年由于大气中 污染物(如氯氟烃CFCI3、CF,CI,和氮氧化物等)不断增加 使臭氧层遭到破坏,从而造成对环境和生物的严重影响。 实验室里利用对氧无声放电来获得臭氧。简单臭氧发 生器装置如图:
15-2-3 臭氧 O3与O2是由同一种元素组成的不同单质,互称同素异 形体。 O3在地面附近的大气层中含量极少,仅占0.001ppm。在 离地面20~40km处有个臭氧层,臭氧浓度高达0.2ppm。 它是氧气吸收太阳的紫外线后形成的。反应为: O2+h(<242nm)===O+O,O+O2==O3 O3+h(=220~320nm)===O2+O 这两种过程最后达到动态平衡,结果形成了一个浓度 相对稳定的臭氧层。正是这臭氧层吸收了高空紫外线的 强辐射,使地球上的生物免遭伤害。但近年由于大气中 污染物(如氯氟烃CFCl3、CF2Cl2和氮氧化物等)不断增加 使臭氧层遭到破坏,从而造成对环境和生物的严重影响。 实验室里利用对氧无声放电来获得臭氧。简单臭氧发 生器装置如图:
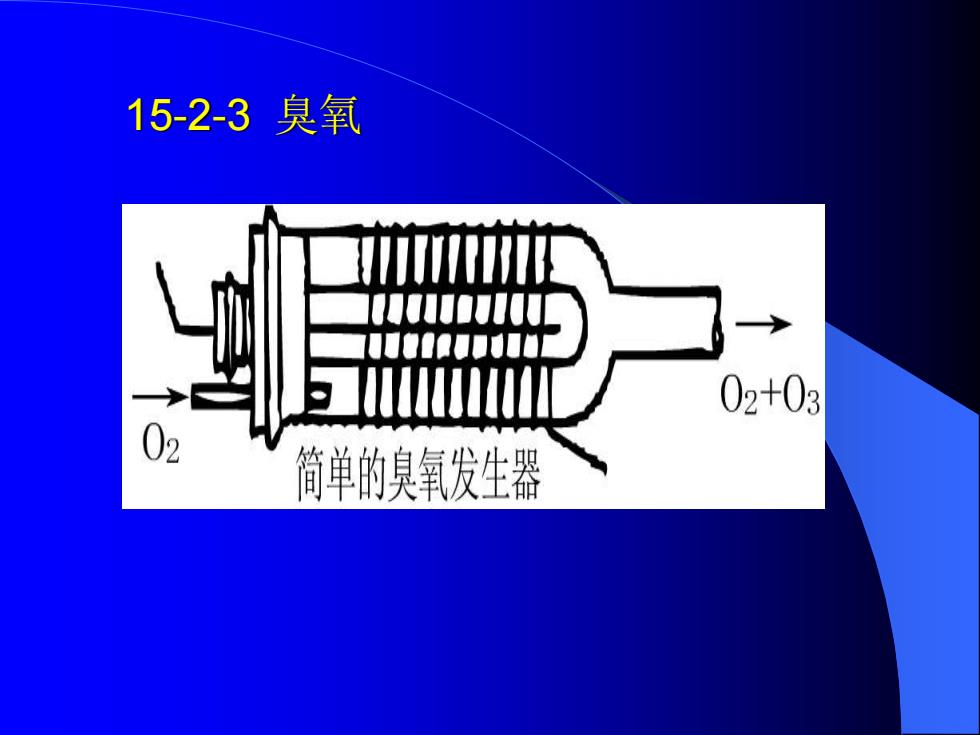
15-2-3臭氧 02+03 简单的臭氧发生器
15-2-3 臭氧
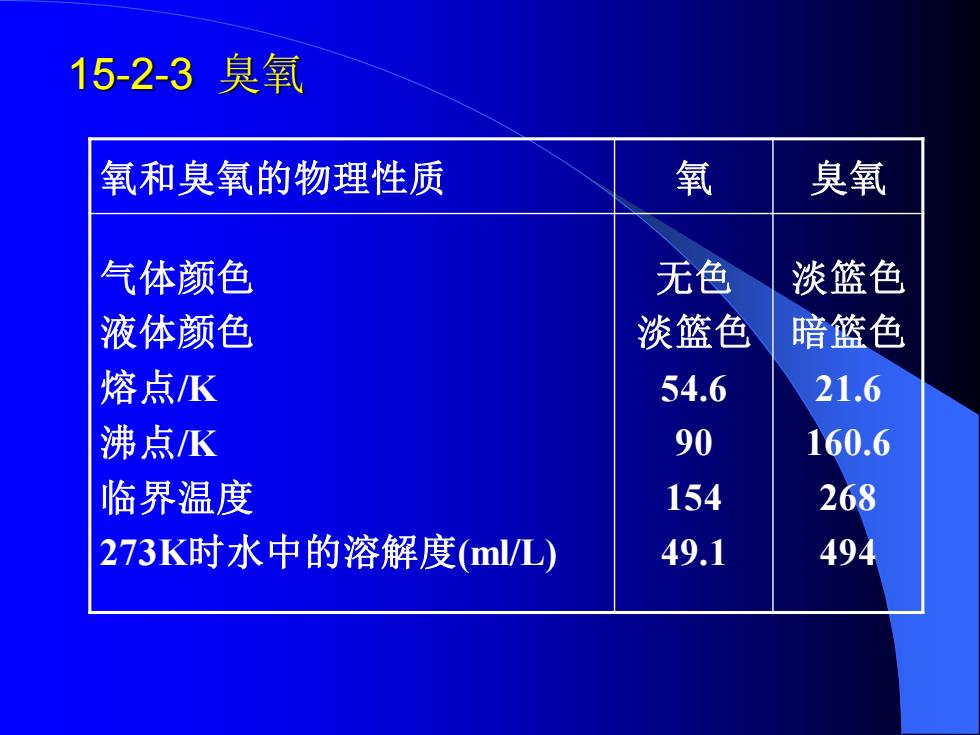
15-2-3臭氧 氧和臭氧的物理性质 氧 臭氧 气体颜色 无色 淡篮色 液体颜色 淡篮色 暗篮色 熔点K 54.6 21.6 沸点K 90 160.6 临界温度 154 268 273K时水中的溶解度(ml/L) 49.1 494
15-2-3 臭氧 氧和臭氧的物理性质 氧 臭氧 气体颜色 液体颜色 熔点/K 沸点/K 临界温度 273K时水中的溶解度(ml/L) 无色 淡篮色 54.6 90 154 49.1 淡篮色 暗篮色 21.6 160.6 268 494