
分子结构认识的二次飞跃: 1.1919年,Lewis&Langmuir提出共价键概念 没有揭示电子配对的内在原因和共价键的本质 2.1929年,Heitler&London引入量子力学,发展起: 价键理论(VB法)和分子轨道理论(MO法) 可解释共价键的两个重要性质:饱和性和方向性 适用范围:VB法一基态分子性质,空间构型、键的离解能 MO法一共轭体系、分子光谱、激发态、磁学性质
1. 1919年,Lewis & Langmuir 提出共价键概念 没有揭示电子配对的内在原因和共价键的本质 2. 1929年,Heitler & London 引入量子力学,发展起: 价键理论(VB法)和分子轨道理论(MO法) 可解释共价键的两个重要性质:饱和性和方向性 适用范围:VB法—基态分子性质,空间构型、键的离解能 MO法—共轭体系、分子光谱、激发态、磁学性质 分子结构认识的二次飞跃:
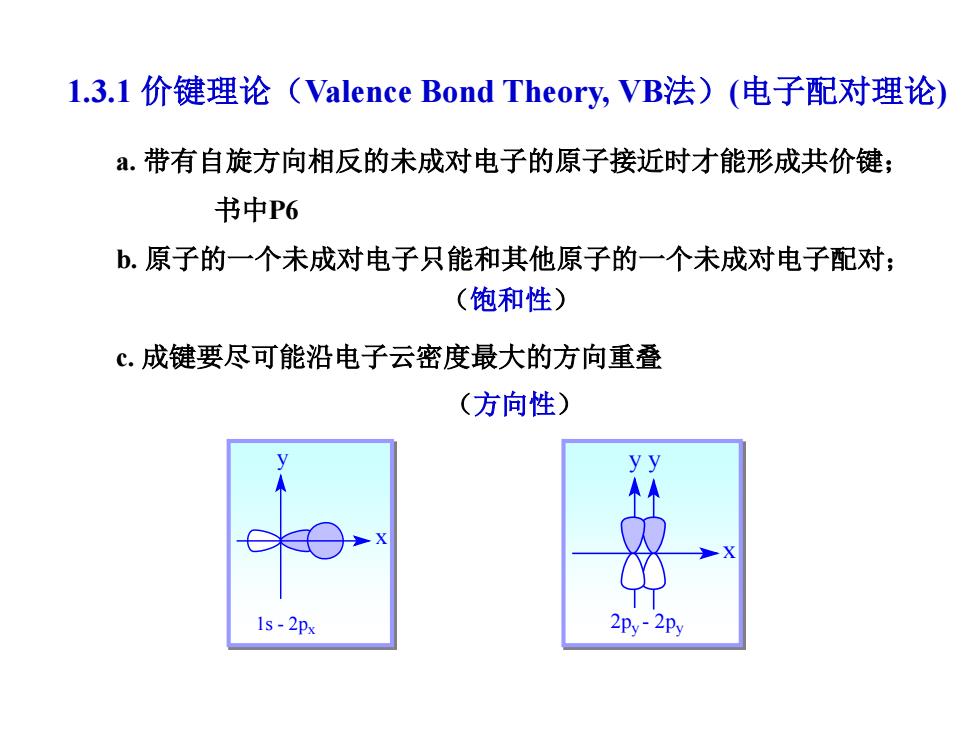
1.3.1价键理论(Valence Bond Theory,VB法)(电子配对理论) a.带有自旋方向相反的未成对电子的原子接近时才能形成共价键; 书中P6 b.原子的一个未成对电子只能和其他原子的一个未成对电子配对; (饱和性) c.成键要尽可能沿电子云密度最大的方向重叠 (方向性) 1s-2px 2py-2Py
1.3.1 价键理论(Valence Bond Theory, VB法)(电子配对理论) a. 带有自旋方向相反的未成对电子的原子接近时才能形成共价键; 书中P6 b. 原子的一个未成对电子只能和其他原子的一个未成对电子配对; c. 成键要尽可能沿电子云密度最大的方向重叠 (饱和性) (方向性) x y 1s - 2px 2py - 2py y y x

A.Electrons with opposite spin form covalent bond. 自旋方向相反的电子配对形成共价键
A.Electrons with opposite spin form covalent bond. 自旋方向相反的电子配对形成共价键 C C C

B.Saturation of a covalent bond共价键具有饱和性 If a electron has been involved in one covalent bond,no third electron would be accepted. 当原子的一个未成键电子与其 他原子的一个电子配对之后,就 不能再与第三个电子配对
B. Saturation of a covalent bond 共价键具有饱和性 C C C If a electron has been involved in one covalent bond, no third electron would be accepted. 当原子的一个未成键电子与其 他原子的一个电子配对之后,就 不能再与第三个电子配对

C.Direction of a covalent bond共价键具有方向性 成键时,两个电子的原子轨道发生重叠,沿电子 云密度最大的方向重叠 两种较稳定的重叠成键方式: 原子轨道沿轨道的对称轴方向重叠 键 两个平行的p轨道侧面交叠 键
C. Direction of a covalent bond 共价键具有方向性 成键时,两个电子的原子轨道发生重叠,沿电子 云密度最大的方向重叠 两种较稳定的重叠成键方式: 原子轨道沿轨道的对称轴方向重叠 σ 键 两个平行的p轨道侧面交叠 π 键