
§62沉淀的生成与溶解 6.2.1溶度积规则 6.2.2同离子效应与盐效应 >6.2.3pH对沉淀溶解平衡的影响 ©>6.2.4配合物的生成对溶解度的影响 沉淀的配位溶解 返回
§ 6.2 沉淀的生成与溶解 6.2.4 配合物的生成对溶解度的影响 ——沉淀的配位溶解 6.2.3 pH 对沉淀溶解平衡的影响 6.2.2 同离子效应与盐效应 6.2.1 溶度积规则

6.2.1溶度积规则 A Bm (s)-nAT(aq)+mB"-(ag) J={c(Am+)}"{c(B-)}m 沉淀一溶解平衡的反应商判据,即溶度积规则: 无 ☆J>K 平衡向左移动,沉淀析出; 化学电产 ☆J=K9 处于平衡状态,饱和溶液; ☆J<K 平衡向右移动,无沉淀析出: 若原来有沉淀存在,则沉淀溶解
m n n m { (A )} { (B )} + - J = c c 沉淀—溶解平衡的反应商判据,即溶度积规则: 6.2.1 溶度积规则 A B (s) nA (aq) mB (aq) m n n m + - + ☆ J > Ksp 平衡向左移动,沉淀析出; ☆ J = Ksp 处于平衡状态,饱和溶液; ☆ J < 平衡向右移动,无沉淀析出; 若原来有沉淀存在,则沉淀溶解。 Ksp
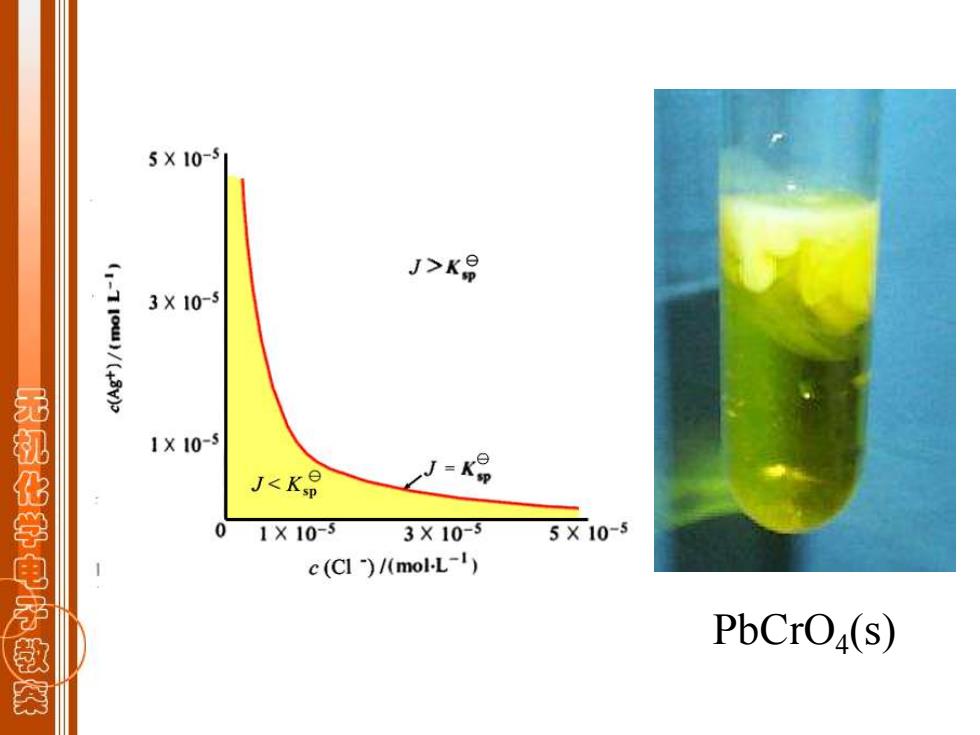
5X10-5 J>K号 3X10-5 1X10-5 无机化学电子教突 J<K0 0 1X10-5 3X10-3 5X10-5 c(CI)/(mol-L-1) PbCrOa(s)
PbCrO4 (s)

例:BaCO,(s)=Ba2+(aq)+CO(aq) ①加酸2H+C0}→H20+C0, c(CO3)↓J↓J<K邪利于BaCO3的溶解。 磊 ②加BaCl或Na2CO, c(Ba2+)个或c(C0})个J个J>K促使 电子 BaCO,的生成。 察
例: 2 2 2 2H + CO3 ⎯→H O + CO + - BaCO3的生成。 ② 加 BaCl2 或 Na2CO3 ① 加酸 BaCO (s) Ba (aq) CO (aq) 2 3 2 3 + - + 利于 BaCO3 的溶解。 2 3 c(CO ) J J < - Ksp c(Ba 2+ ) 或 c(CO 3 2- ) J J > Ksp 促使

例题:25℃时,晴纶纤维生产的某种溶液中, c(S0子)为6.0×104molL1。若在40.0L该 溶液中,加入0.010molL1BaC1,溶液 10.0L,问是否能生成BaSO沉淀?如果有 沉淀生成,问能生成BaSO4多少克?最后溶 化学电子教菜 液中c(SO)是多少?
为 6. 0×10-4 mol·L-1 。若在 40.0L该 溶液中,加入 0.010mol·L-1 BaCl2溶液 10.0L ,问是否能生成BaSO4 沉淀?如果有 沉淀生成,问能生成 BaSO4多少克?最后溶 液中 是多少? (SO ) 2 4 - c (SO ) 2 4 - c 例题:25℃时,晴纶纤维生产的某种溶液中