
第四章 化学反应与电能 第一节原电池 第1课时原电池 课后·训练提升 基础巩固 1.下列关于原电池的叙述正确的是( ) A.构成原电池的正极和负极必须是两种不同的金属 B.原电池是将化学能转化为电能的装置 C.原电池中电子流出的一极是负极,该极被还原 D.原电池工作时,电流的方向是从负极到正极 答案B 解析:A项,构成原电池的正极和负极可能是两种不同的金属,也可能是导电的非 金属(如石墨棒)和金属等,错误B项,原电池是将化学能转化为电能的装置,正确:C 项,在原电池中,负极上失去电子,发生氧化反应,正极上得到电子,发生还原反应,电 子从负极沿导线流向正极,错误,D项,原电池放电时,电子从负极沿导线流向正极, 电流的方向是从正极到负极,错误。 2.在如图所示的8个装置中,属于原电池的是( Zn (含石墨) Zn 稀硫酸 稀硫酸 HC1溶液 稀硫酸 ① ② ③ ④ Fe Fe e 222 酒精 稀硫酸 CuCl,溶液 稀硫酸 ⑤ ⑥ ⑦ ⑧ A.①④ B.③⑤ c.④⑧ D.②④⑥⑦ 答案D 解析:根据原电池的构成条件可知:①中只有一个电极③中两电极材料相同,⑤中 酒精不是电解质,不能导电,⑧中两电极材料相同且未形成闭合回路,故①③⑤⑧ 均不能构成原电池
第四章 化学反应与电能 第一节 原电池 第 1 课时 原电池 课后· 基础巩固 1.下列关于原电池的叙述正确的是( )。 A.构成原电池的正极和负极必须是两种不同的金属 B.原电池是将化学能转化为电能的装置 C.原电池中电子流出的一极是负极,该极被还原 D.原电池工作时,电流的方向是从负极到正极 答案:B 解析:A 项,构成原电池的正极和负极可能是两种不同的金属,也可能是导电的非 金属(如石墨棒)和金属等,错误;B 项,原电池是将化学能转化为电能的装置,正确;C 项,在原电池中,负极上失去电子,发生氧化反应,正极上得到电子,发生还原反应,电 子从负极沿导线流向正极,错误;D 项,原电池放电时,电子从负极沿导线流向正极, 电流的方向是从正极到负极,错误。 2.在如图所示的 8 个装置中,属于原电池的是( )。 A.①④ B.③⑤ C.④⑧ D.②④⑥⑦ 答案:D 解析:根据原电池的构成条件可知:①中只有一个电极,③中两电极材料相同,⑤中 酒精不是电解质,不能导电,⑧中两电极材料相同且未形成闭合回路,故①③⑤⑧ 均不能构成原电池

3将铁片和银片用导线连接放置在同一稀盐酸中,并经过一段时间后,下列叙述中 正确的是() A.负极有C2逸出,正极有H2逸出 B.负极附近C的浓度减小 C.正极附近C的浓度逐渐增大 D.溶液中C的浓度基本不变 答案D 解析:在本原电池中,Fe作负极,电极反应式为Fe-2eFe2+,Ag作正极,电极反应 式为2H+2e一H2↑,所以A中无C2逸出,原电池中C移向负极,所以负极附近 C的浓度增大,正极附近C的浓度减小,但整个溶液中C的浓度基本不变。 4如图所示,盐桥中装有含KC1饱和溶液的琼脂。下列有关原电池的叙述中正确 的是( G CuSO4溶液 ZnSO4溶液 A.铜片上发生氧化反应 B.取出盐桥后,电流计指针依然发生偏转 C.反应中,盐桥中的K+会移向CuSO4溶液 D.反应前后铜片质量不改变 答案C 解析:左侧Cu+放电,发生还原反应,铜电极上有铜析出,铜片质量增大,A项、D项 错误:取出盐桥后,不能形成闭合回路,无电流,指针不偏转,B项错误;原电池中,盐 桥中阳离子向正极移动,C项正确。 5.可以将反应Zn+Br2一ZnB2设计成原电池,下列4个电极反应: ①Br2+2e2Br ②2Br-2eBr2 ③Zn-2eZn2+ ④Zn2++2eZn 其中表示放电时负极和正极反应的分别是()。 A.②和③ B.②和① C.③和① D.④和① 答案C 解析:放电时负极反应物为Zn,失电子被氧化;正极反应物为Br2,得电子被还原。 6如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子 流向如图所示,下列有关此装置的说法正确的是(
3.将铁片和银片用导线连接放置在同一稀盐酸中,并经过一段时间后,下列叙述中 正确的是( )。 A.负极有 Cl2 逸出,正极有 H2 逸出 B.负极附近 Cl-的浓度减小 C.正极附近 Cl-的浓度逐渐增大 D.溶液中 Cl-的浓度基本不变 答案:D 解析:在本原电池中,Fe 作负极,电极反应式为 Fe-2e- Fe2+,Ag 作正极,电极反应 式为 2H++2e- H2↑,所以 A 中无 Cl2 逸出,原电池中 Cl-移向负极,所以负极附近 Cl-的浓度增大,正极附近 Cl-的浓度减小,但整个溶液中 Cl-的浓度基本不变。 4.如图所示,盐桥中装有含 KCl 饱和溶液的琼脂。下列有关原电池的叙述中正确 的是( )。 A.铜片上发生氧化反应 B.取出盐桥后,电流计指针依然发生偏转 C.反应中,盐桥中的 K+会移向 CuSO4 溶液 D.反应前后铜片质量不改变 答案:C 解析:左侧 Cu2+放电,发生还原反应,铜电极上有铜析出,铜片质量增大,A 项、D 项 错误;取出盐桥后,不能形成闭合回路,无电流,指针不偏转,B 项错误;原电池中,盐 桥中阳离子向正极移动,C 项正确。 5.可以将反应 Zn+Br2 ZnBr2 设计成原电池,下列 4 个电极反应: ①Br2+2e- 2Br- ②2Br- -2e- Br2 ③Zn-2e- Zn2+ ④Zn2++2e- Zn 其中表示放电时负极和正极反应的分别是( )。 A.②和③ B.②和① C.③和① D.④和① 答案:C 解析:放电时负极反应物为 Zn,失电子被氧化;正极反应物为 Br2,得电子被还原。 6.如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子 流向如图所示,下列有关此装置的说法正确的是( )
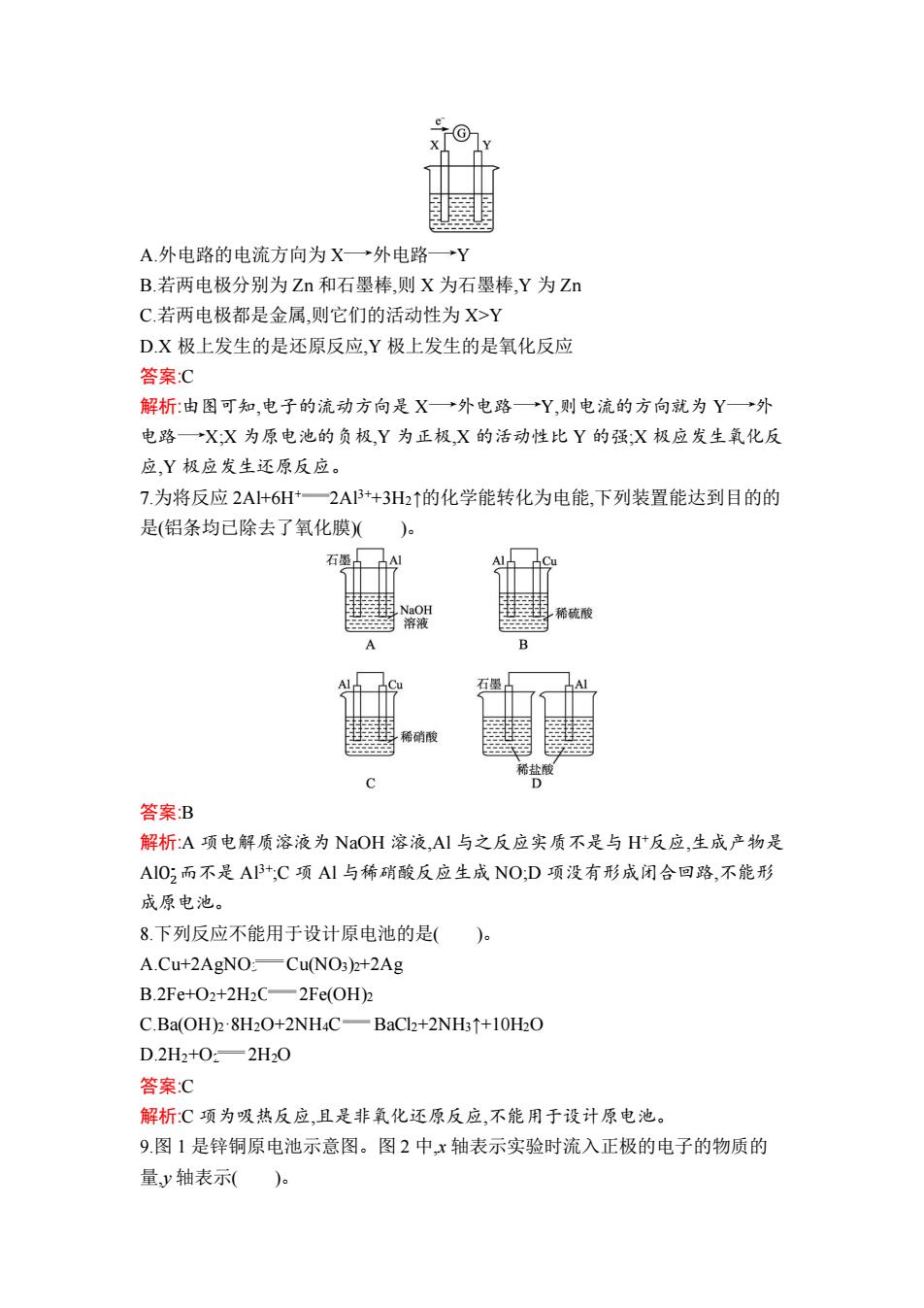
TG A.外电路的电流方向为X→外电路Y B.若两电极分别为Zn和石墨棒,则X为石墨棒Y为Zn C.若两电极都是金属,则它们的活动性为X>Y D.X极上发生的是还原反应,Y极上发生的是氧化反应 答案:C 解析:由图可知,电子的流动方向是X→外电路→Y,则电流的方向就为Y→外 电路→X:X为原电池的负极,Y为正极,X的活动性比Y的强:X极应发生氧化反 应,Y极应发生还原反应。 7.为将反应2A+6H+一2A13+3H2↑的化学能转化为电能,下列装置能达到目的的 是(铝条均已除去了氧化膜)( 石墨 NaOH 稀硫酸 溶液 B 石墨 稀硝酸 稀盐履 C D 答案B 解析:A项电解质溶液为NaOH溶液,Al与之反应实质不是与Ht反应,生成产物是 AIO;而不是A3+,C项A1与稀硝酸反应生成NO:D项没有形成闭合回路,不能形 成原电池。 8.下列反应不能用于设计原电池的是()。 A.Cu+2AgNO:Cu(NO3)2+2Ag B.2Fe+O2+2H2C-2Fe(OH)2 C.Ba(OH)28H2O+2NH4C-BaCl2+2NH31+10H2O D.2H2+0:—2H20 答案:C 解析:C项为吸热反应,且是非氧化还原反应,不能用于设计原电池。 9.图1是锌铜原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的 量,y轴表示()
A.外电路的电流方向为 X 外电路 Y B.若两电极分别为 Zn 和石墨棒,则 X 为石墨棒,Y 为 Zn C.若两电极都是金属,则它们的活动性为 X>Y D.X 极上发生的是还原反应,Y 极上发生的是氧化反应 答案:C 解析:由图可知,电子的流动方向是 X 外电路 Y,则电流的方向就为 Y 外 电路 X;X 为原电池的负极,Y 为正极,X 的活动性比 Y 的强;X 极应发生氧化反 应,Y 极应发生还原反应。 7.为将反应 2Al+6H+ 2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的 是(铝条均已除去了氧化膜)( )。 答案:B 解析:A 项电解质溶液为 NaOH 溶液,Al 与之反应实质不是与 H+反应,生成产物是 AlO2 - 而不是 Al3+;C 项 Al 与稀硝酸反应生成 NO;D 项没有形成闭合回路,不能形 成原电池。 8.下列反应不能用于设计原电池的是( )。 A.Cu+2AgNO3 Cu(NO3)2+2Ag B.2Fe+O2+2H2O 2Fe(OH)2 C.Ba(OH)2·8H2O+2NH4Cl BaCl2+2NH3↑+10H2O D.2H2+O2 2H2O 答案:C 解析:C 项为吸热反应,且是非氧化还原反应,不能用于设计原电池。 9.图 1 是锌铜原电池示意图。图 2 中,x 轴表示实验时流入正极的电子的物质的 量,y 轴表示( )

Zn Cu 由稀硫酸 图 图2 A.铜棒的质量B.c(Zn+) C.c(H+) D.c(SO) 答案:C 解析:在正极Cu上,溶液中的H+获得电子变为氢气,铜棒的质量不变,A项错误;由 于Zn是负极,不断发生反应Zn-2e一Zn2+,所以溶液中c(亿n+)增大,B项错误;由 于反应不断消耗H+,所以溶液中c(H)逐渐降低,C项正确:S0子不参加反应,其浓 度不变,D项错误。 10.A、B、C、D四种金属按下表中的装置图进行实验。 编号 甲 丙 装置 稀硫酸 CuSO,溶液 稀硫酸 现象 A不断溶解生成二价离子 C的质量增大 A上有气泡产生 根据实验现象回答下列问题。 (1)装置甲中负极的电极反应是 (2)装置乙中正极的电极反应是 (3)装置丙中溶液的pH (填“变大变小”或“不变)。 (4)四种金属活动性由强到弱的顺序是 答案:(1)A-2e一A2+(2)Cu2+2e—Cu(3)变大(4)D>A>B>C 解析:甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为负 极、B为正极,活动性A>B:乙中C的质量增大,即析出Cu,则B为负极,活动性 B>C;丙中A上有气泡即H2产生,则A为正极,活动性D>A,随着H的消耗,溶液 pH逐渐变大。 11.如图所示为某实验小组设计的原电池
图 1 图 2 A.铜棒的质量 B.c(Zn2+) C.c(H+ ) D.c(SO4 2- ) 答案:C 解析:在正极 Cu 上,溶液中的 H+获得电子变为氢气,铜棒的质量不变,A 项错误;由 于 Zn 是负极,不断发生反应:Zn-2e- Zn2+ ,所以溶液中 c(Zn2+)增大,B 项错误;由 于反应不断消耗 H+ ,所以溶液中 c(H+ )逐渐降低,C 项正确; SO4 2-不参加反应,其浓 度不变,D 项错误。 10.A、B、C、D 四种金属按下表中的装置图进行实验。 编号 甲 乙 丙 装置 现象 A 不断溶解生成二价离子 C 的质量增大 A 上有气泡产生 根据实验现象回答下列问题。 (1)装置甲中负极的电极反应是 。 (2)装置乙中正极的电极反应是 。 (3)装置丙中溶液的 pH (填“变大”“变小”或“不变”)。 (4)四种金属活动性由强到弱的顺序是 。 答案:(1)A-2e- A2+ (2)Cu2++2e- Cu (3)变大 (4)D>A>B>C 解析:甲、乙、丙均为原电池装置。依据原电池原理,甲中 A 不断溶解,则 A 为负 极、B 为正极,活动性 A>B;乙中 C 的质量增大,即析出 Cu,则 B 为负极,活动性 B>C;丙中 A 上有气泡即 H2 产生,则 A 为正极,活动性 D>A,随着 H+的消耗,溶液 pH 逐渐变大。 11.如图所示为某实验小组设计的原电池:
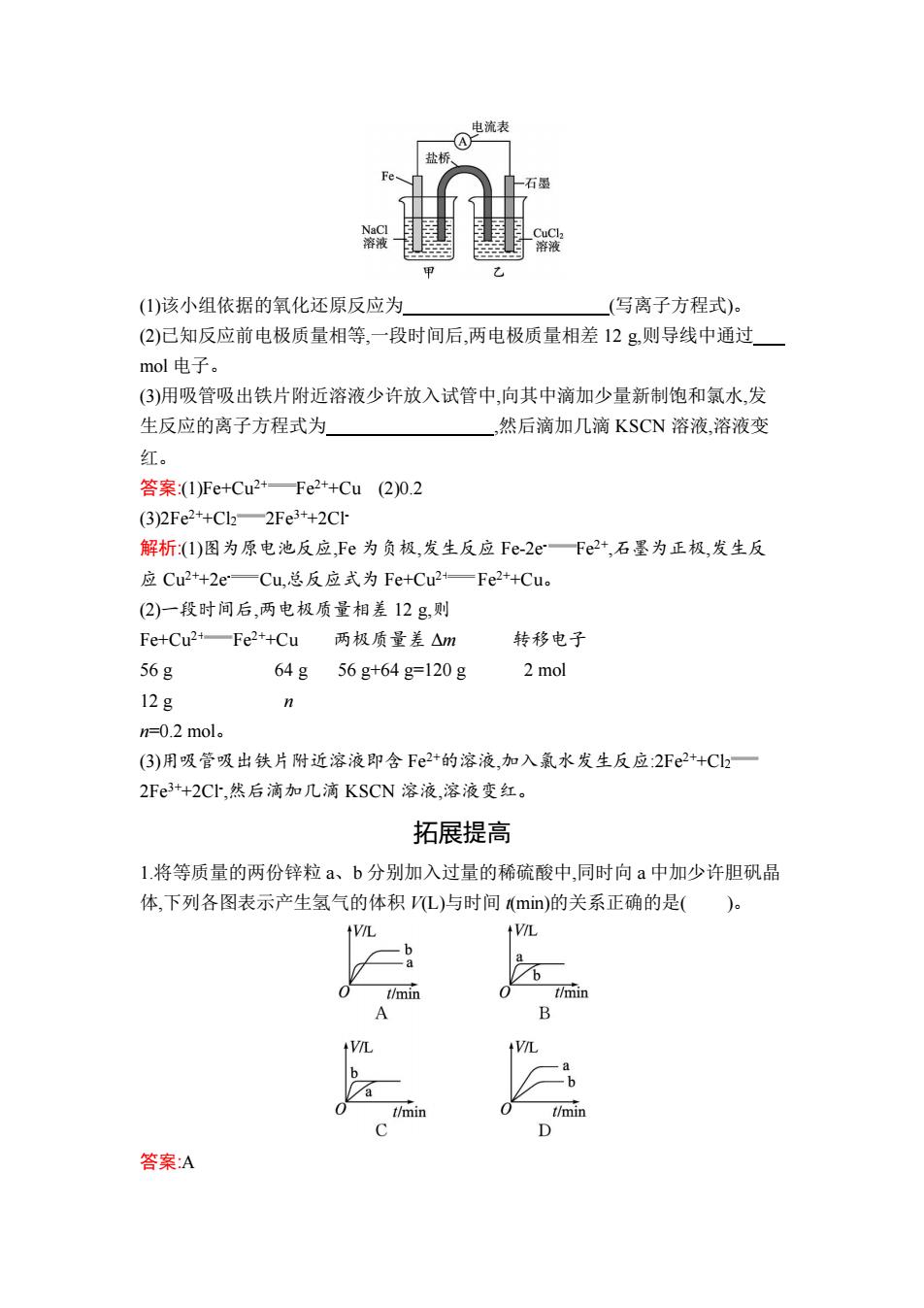
电流表 盐桥 石墨 溶液 (1)该小组依据的氧化还原反应为 (写离子方程式)。 (2)已知反应前电极质量相等,一段时间后,两电极质量相差12g,则导线中通过 mol电子。 (3)用吸管吸出铁片附近溶液少许放入试管中,向其中滴加少量新制饱和氯水,发 生反应的离子方程式为 然后滴加几滴KSCN溶液,溶液变 红。 答案:(1)Fe+Cu2+Fe2+Cu(2)0.2 (3)2Fe2+Cl22Fe3+2C1 解析:(1)图为原电池反应,Fe为负极,发生反应Fe2eFe+,石墨为正极,发生反 应Cu2+2e—Cu,总反应式为Fe+Cu2+一Fe2++Cu。 (2)一段时间后,两电极质量相差12g,则 Fe+Cu2+—Fe2+Cu 两极质量差△m 转移电子 56g 64g 56g+64g=120g 2 mol 12g n n=0.2mol.。 (3)用吸管吸出铁片附近溶液即含F2+的溶液,加入氯水发生反应:2Fe2+Cl2一 2Fe3+2C,然后滴加几滴KSCN溶液,溶液变红。 拓展提高 1.将等质量的两份锌粒a、b分别加入过量的稀硫酸中,同时向a中加少许胆矾晶 体,下列各图表示产生氢气的体积L)与时间(min)的关系正确的是()。 V V b t/min t/min A B VL +V/L -b t/min t/min D 答案A
(1)该小组依据的氧化还原反应为 (写离子方程式)。 (2)已知反应前电极质量相等,一段时间后,两电极质量相差 12 g,则导线中通过 mol 电子。 (3)用吸管吸出铁片附近溶液少许放入试管中,向其中滴加少量新制饱和氯水,发 生反应的离子方程式为 ,然后滴加几滴 KSCN 溶液,溶液变 红。 答案:(1)Fe+Cu2+ Fe2++Cu (2)0.2 (3)2Fe2++Cl2 2Fe3++2Cl- 解析:(1)图为原电池反应,Fe 为负极,发生反应 Fe-2e- Fe2+ ,石墨为正极,发生反 应 Cu2++2e- Cu,总反应式为 Fe+Cu2+ Fe2++Cu。 (2)一段时间后,两电极质量相差 12 g,则 Fe+Cu2+ Fe2++Cu 两极质量差 Δm 转移电子 56 g 64 g 56 g+64 g=120 g 2 mol 12 g n n=0.2 mol。 (3)用吸管吸出铁片附近溶液即含 Fe2+的溶液,加入氯水发生反应:2Fe2++Cl2 2Fe3++2Cl- ,然后滴加几滴 KSCN 溶液,溶液变红。 拓展提高 1.将等质量的两份锌粒 a、b 分别加入过量的稀硫酸中,同时向 a 中加少许胆矾晶 体,下列各图表示产生氢气的体积 V(L)与时间 t(min)的关系正确的是( )。 答案:A