
第一章过关检测 (时间:90分钟满分:100分) 一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题 意) 1.下列说法中正确的是()。 A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 B.凡是在加热或点燃条件下进行的反应都是吸热反应 C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式 D.氢气在氧气中燃烧生成H2O(g)的热化学方程式是2H2(g十O2(g,一2H2O(g) △H=-483.6kJ 答案:C 解析:热化学方程式需写出物质的聚集状态,A项错误;放热反应也可能在加热或 ,点燃条件下进行,B项错误:D项△H的单位错误,应为kJ-mol-1。 2.下列关于化学反应与能量变化的说法正确的是()。 A.放热反应的发生无需任何条件 B.化学键的断裂和形成与反应放热和吸热无关 C.化学反应过程都伴随着能量的变化 D.硫酸与NaOH的反应是吸热反应 答案:C 解析:放热反应的发生可能需要条件,例如加热、点燃等,A项错误;化学键的断裂 和形成过程中吸收的能量与放出的能量不同,才有化学反应的放热和吸热,B项错 误:化学反应过程都伴随着能量的变化,C项正确:酸碱中和反应都是放热反应,D 项错误。 3.下列关于△H的说法正确的是( 焓H↑ 反应物 生成物 A.反应过程中,消耗的反应物越多,△H越大 B.△>O时反应放热,△H<0时反应吸热 C,△H越大,说明反应放出的热量越多 D.能量变化如图所示的化学反应为放热反应,△H为” 答案D 解析:△H与化学方程式中的化学计量数有关,与反应物的用量无关,A项错误。 △H0时反应吸热,△H<0时反应放热,B项错误。反应放出的热量越多,△H越小
第一章过关检测 (时间:90 分钟 满分:100 分) 一、选择题(本题共 15 小题,每小题 3 分,共 45 分。每小题只有一个选项符合题 意) 1.下列说法中正确的是( )。 A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 B.凡是在加热或点燃条件下进行的反应都是吸热反应 C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式 D.氢气在氧气中燃烧生成 H2O(g)的热化学方程式是 2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ 答案:C 解析:热化学方程式需写出物质的聚集状态,A 项错误;放热反应也可能在加热或 点燃条件下进行,B 项错误;D 项 ΔH 的单位错误,应为 kJ·mol-1。 2.下列关于化学反应与能量变化的说法正确的是( )。 A.放热反应的发生无需任何条件 B.化学键的断裂和形成与反应放热和吸热无关 C.化学反应过程都伴随着能量的变化 D.硫酸与 NaOH 的反应是吸热反应 答案:C 解析:放热反应的发生可能需要条件,例如加热、点燃等,A 项错误;化学键的断裂 和形成过程中吸收的能量与放出的能量不同,才有化学反应的放热和吸热,B 项错 误;化学反应过程都伴随着能量的变化,C 项正确;酸碱中和反应都是放热反应,D 项错误。 3.下列关于 ΔH 的说法正确的是( )。 A.反应过程中,消耗的反应物越多,ΔH 越大 B.ΔH>0 时反应放热,ΔH<0 时反应吸热 C.ΔH 越大,说明反应放出的热量越多 D.能量变化如图所示的化学反应为放热反应,ΔH 为“-” 答案:D 解析:ΔH 与化学方程式中的化学计量数有关,与反应物的用量无关,A 项错误。 ΔH>0 时反应吸热,ΔH<0 时反应放热,B 项错误。反应放出的热量越多,ΔH 越小

反应吸收的热量越多,△H越大,C项错误。由于反应物的总焓大于生成物的总焓, 故由反应物转化为生成物时,该反应为放热反应,△H为“”,D项正确。 4.已知强酸的稀溶液与强碱的稀溶液发生中和反应,生成1olH2O时的热效应 △H=-57.3 kJ-mol-1。向1L0.5molL1NaOH溶液中分别加入:①稀醋酸、②浓疏 酸、③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,其关系正确的 是( )。 A.△H1>△H3>△H2 B.△H=△H=△H3 C.△H1<△H3<△H2 D.△H1=△H3<△H2 答案:A 解析:相同浓度、相同体积的NOH溶液与稀醋酸、浓硫酸、稀硝酸恰好完全反 应,若不考虑弱酸电离吸热和浓硫酸溶于水放热,应放出相同的热量。但实际反应 中,浓硫酸溶于水放热:CH3COOH是弱酸,电离过程吸热。比较△H、△2、△H3 的大小时,要注意其均为负值。 5.下列对H2(g+C2(g)一2HCI(g)△H=-184.6kJmo1的叙述正确的是()。 A.1分子H2和1分子C2反应,放出热量184.6kJ B.1molH2(g)完全反应生成2 mol HCI(g),放出的热量为184.6kJ C.在25℃和101kPa的条件下,1molH(g)与1 mol Cl2(g)完全反应生成2mol HCl(g),放出的热量为184.6kJ D.在25℃和101kPa的条件下,1molH2(g)与1molC(g)完全反应生成2mol HCl(g),吸收的热量为184.6kJ 答案:C 解析:热化学方程式中△H的值与具体化学反应相对应,在反应中各物质前的化学 计量数不再表示粒子数目,只表示物质的“物质的量”,所以A项中分子个数的说 法是错误的。在描述反应时应说明外界条件,而B项中没有温度和压强,该说法 也是错误的。△H<0,反应放热而非吸热,D项错误。 6.下列热化学方程式书写正确的是()。 A.C2H5OH+3O一2C02+3H20△H=-1367.0kJmo1 B.NaOH(aq)+HCI(aq)NaCl(aq)+H2O(1)AH=+57.3 kJ-mol-I C.S(s)+O2(g)-SO2(g)AH=-269.8 kJ-mol-1 D.2NO(gtO2(g)—2NO2(g)△H=-116.2kJ 答案:C 解析:热化学反应方程式要标出物质的聚集状态,A项错误:酸碱中和反应放热,△H 应小于0,B项错误;反应热△H的单位是kJol,D项错误。 7.在一定条件下,CO和CH4燃烧的热化学方程式分别为: 2C0(g+02(g)2C02(g)△H=-566kJmo1
反应吸收的热量越多,ΔH 越大,C 项错误。由于反应物的总焓大于生成物的总焓, 故由反应物转化为生成物时,该反应为放热反应,ΔH 为“-”,D 项正确。 4.已知强酸的稀溶液与强碱的稀溶液发生中和反应,生成 1 mol H2O 时的热效应 ΔH=-57.3 kJ·mol-1。向 1 L 0.5 mol·L -1 NaOH 溶液中分别加入:①稀醋酸、②浓硫 酸、③稀硝酸,恰好完全反应时的热效应分别为 ΔH1、ΔH2、ΔH3,其关系正确的 是( )。 A.ΔH1>ΔH3>ΔH2 B.ΔH1=ΔH2=ΔH3 C.ΔH1<ΔH3<ΔH2 D.ΔH1=ΔH3<ΔH2 答案:A 解析:相同浓度、相同体积的 NaOH 溶液与稀醋酸、浓硫酸、稀硝酸恰好完全反 应,若不考虑弱酸电离吸热和浓硫酸溶于水放热,应放出相同的热量。但实际反应 中,浓硫酸溶于水放热;CH3COOH 是弱酸,电离过程吸热。比较 ΔH1、ΔH2、ΔH3 的大小时,要注意其均为负值。 5.下列对 H2(g)+Cl2(g) 2HCl(g) ΔH=-184.6 kJ·mol-1 的叙述正确的是( )。 A.1 分子 H2 和 1 分子 Cl2 反应,放出热量 184.6 kJ B.1 mol H2(g)完全反应生成 2 mol HCl(g),放出的热量为 184.6 kJ C.在 25 ℃和 101 kPa 的条件下,1 mol H2(g)与 1 mol Cl2(g)完全反应生成 2 mol HCl(g),放出的热量为 184.6 kJ D.在 25 ℃和 101 kPa 的条件下,1 mol H2(g)与 1 mol Cl2(g)完全反应生成 2 mol HCl(g),吸收的热量为 184.6 kJ 答案:C 解析:热化学方程式中 ΔH 的值与具体化学反应相对应,在反应中各物质前的化学 计量数不再表示粒子数目,只表示物质的“物质的量”,所以 A 项中分子个数的说 法是错误的。在描述反应时应说明外界条件,而 B 项中没有温度和压强,该说法 也是错误的。ΔH<0,反应放热而非吸热,D 项错误。 6.下列热化学方程式书写正确的是( )。 A.C2H5OH+3O2 2CO2+3H2O ΔH=-1 367.0 kJ·mol-1 B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1 C.S(s)+O2(g) SO2(g) ΔH=-269.8 kJ·mol-1 D.2NO(g)+O2(g) 2NO2(g) ΔH=-116.2 kJ 答案:C 解析:热化学反应方程式要标出物质的聚集状态,A 项错误;酸碱中和反应放热,ΔH 应小于 0,B 项错误;反应热 ΔH 的单位是 kJ·mol-1 ,D 项错误。 7.在一定条件下,CO 和 CH4 燃烧的热化学方程式分别为: 2CO(g)+O2(g) 2CO2(g) ΔH=-566 kJ·mol-1

CH4(g+2O2(g)一CO2(g+2HO0)△H=-890kJmo 由1 mol CO和3 mol CH4组成的混合气体在上述条件下完全燃烧时,释放的热量 为( ) A.2953kJ B.3236kJ C.2588kJ D.1739kJ 答案:A 解析:根据热化学方程式可知,1 mol CO完全燃烧放出的热量是283kJ,3 mol CH4 完全燃烧放出的热量是890kJ×3=2670kJ,释放的总热量为283kJ+2670kJ=2 953kJ。 8.己知:①2H(g+O2(g)一2H00△H=-571.6 kJ-mol-I;②Ht(aq+OH(aq) H2O①△H=-57.3 kJ-mol-1。下列说法中错误的是()。 A.①式表示25℃和101kPa时,2molH2(g)和1molO2(g)完全燃烧生成2mol H20①放热571.6kJ B.2H2(g十02(g)一2H0(g)中△H-571.6kJmo1 C.将含1 mol NaOH的水溶液与50g98%的浓硫酸混合后放出的热量为57.3kJ D.将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量 小于57.3kJ 答案:C 解析:C项过程还伴随着浓硫酸稀释所放出的热量,故放出的热量大于57.3kJ。 9.氧气(O2)和臭氧(O3)是氧元素的两种同素异形体。已知热化学方程式 ①4A1(s+3O2(g)一2Al2O3(S)△H ②4AI(S+2O3(g)2AhO3(S)△H2 ③302(g)一203(g)△H3 下列关系式正确的是() A.△H1-△H2=△H3 B.△H1+△H2=△H3 C.△H2-△H1=△H D.△H1+△H2+△H3=0 答案:A 解析:根据盖斯定律可知:反应式①-②得③,所以△H3=△1-△H2。 10.已知反应X+Y一M+N为放热反应,对该反应的下列说法中正确的是( A.X的能量一定高于M B.Y的能量一定高于N C.X和Y的总能量一定高于M和N的总能量 D.因该反应为放热反应,故不必加热就可发生反应
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1 由 1 mol CO 和 3 mol CH4 组成的混合气体在上述条件下完全燃烧时,释放的热量 为( )。 A.2 953 kJ B.3 236 kJ C.2 588 kJ D.1 739 kJ 答案:A 解析:根据热化学方程式可知,1 mol CO 完全燃烧放出的热量是 283 kJ,3 mol CH4 完全燃烧放出的热量是 890 kJ×3=2 670 kJ,释放的总热量为 283 kJ+2 670 kJ=2 953 kJ。 8.已知:①2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1 ;②H+ (aq)+OH- (aq) H2O(l) ΔH=-57.3 kJ·mol-1。下列说法中错误的是( )。 A.①式表示 25 ℃和 101 kPa 时,2 mol H2 (g)和 1 mol O2(g)完全燃烧生成 2 mol H2O(l)放热 571.6 kJ B.2H2(g)+O2(g) 2H2O(g)中 ΔH>-571.6 kJ·mol-1 C.将含 1 mol NaOH 的水溶液与 50 g 98%的浓硫酸混合后放出的热量为 57.3 kJ D.将含 1 mol NaOH 的稀溶液与含 1 mol CH3COOH 的稀溶液混合后放出的热量 小于 57.3 kJ 答案:C 解析:C 项过程还伴随着浓硫酸稀释所放出的热量,故放出的热量大于 57.3 kJ。 9.氧气(O2)和臭氧(O3)是氧元素的两种同素异形体。已知热化学方程式: ①4Al(s)+3O2(g) 2Al2O3(s) ΔH1 ②4Al(s)+2O3(g) 2Al2O3(s) ΔH2 ③3O2(g) 2O3(g) ΔH3 下列关系式正确的是( )。 A.ΔH1-ΔH2=ΔH3 B.ΔH1+ΔH2=ΔH3 C.ΔH2-ΔH1=ΔH3 D.ΔH1+ΔH2+ΔH3=0 答案:A 解析:根据盖斯定律可知:反应式①-②得③,所以 ΔH3=ΔH1-ΔH2。 10.已知反应 X+Y M+N 为放热反应,对该反应的下列说法中正确的是( )。 A.X 的能量一定高于 M B.Y 的能量一定高于 N C.X 和 Y 的总能量一定高于 M 和 N 的总能量 D.因该反应为放热反应,故不必加热就可发生反应

答案:C 解析:该反应为放热反应,所以反应物的总能量大于生成物的总能量,即X和Y的 总能量一定高于M和N的总能量,A、B两项错误,C项正确:反应的放热、吸热 与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反 应,D项错误。 11.通过以下反应均可获取H2。下列有关说法正确的是()。 ①太阳光催化分解水制氢:2H2O①一2H2(g+O2(g)△H1=+571.6kJmo ②焦炭与水反应制氢:C(s十H2O(g)一CO(g+H2(g)△H=+131.3kJmo ③甲烷与水反应制氢:CH4(g+H2O(g,一CO(g十3H2(g)△H3=+206.1kJmo A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用不同的催化剂,△H不同 D.反应CH4(g)一C(s十2H(g)的△H=+74.8 kJ-mol-! 答案D 解析:太阳光催化分解水制氢气,是光能转化为化学能,A项错误;反应②的△H2>0, 故该反应为吸热反应,B项错误;△H3只与反应的始态和终态有关,使用不同的催化 剂,△H3相同,C项错误;根据盖斯定律,目标反应CH4(g,一C(S十2H2(g)相当于③ ②,故△H=△H3-△H2,△H=206.1 kJ-mol-1-131.3 kJ-mol-1=74.8 kJ-mol-1,D项正确。 12.将1gH2与4gO2在点燃条件下充分反应,放出71.45kJ热量。在相同条件 下,1molH2在足量O2中完全燃烧放出的热量是( A.71.45kJ B.142.9kJ C.571.6kJ D.285.8kJ 答案D 解析:1gH2与4gO2反应时,H2剩余,实际参加反应的H2为0.5g,1molH2的质量 为2g,因此1olH2在02中完全燃烧放出的热量为71.45kJ×4=285.8kJ。 13.已知热化学方程式: ①C2H(g十02(g,一2C02(g+H00△H1=-1301.0kJmo ②C(s+02(g)C02(g)△H2=-393.5kJmo1 ③H2(g+202(g,一H00△H=285.8kJmo 则反应④2C(s+H2(g)C2H(g)的△H为()。 A.+228.2 kJ.mol- B.-228.2 kJ-mol-1 C.+1301.0kJmo D.+621.7 kJ-mol-1
答案:C 解析:该反应为放热反应,所以反应物的总能量大于生成物的总能量,即 X 和 Y 的 总能量一定高于 M 和 N 的总能量,A、B 两项错误,C 项正确;反应的放热、吸热 与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反 应,D 项错误。 11.通过以下反应均可获取 H2。下列有关说法正确的是( )。 ①太阳光催化分解水制氢:2H2O(l) 2H2(g)+O2(g) ΔH1=+571.6 kJ·mol-1 ②焦炭与水反应制氢:C(s)+H2O(g) CO(g)+H2(g) ΔH2=+131.3 kJ·mol-1 ③甲烷与水反应制氢:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1 A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用不同的催化剂,ΔH3 不同 D.反应 CH4(g) C(s)+2H2(g)的 ΔH=+74.8 kJ·mol-1 答案:D 解析:太阳光催化分解水制氢气,是光能转化为化学能,A 项错误;反应②的 ΔH2>0, 故该反应为吸热反应,B 项错误;ΔH3 只与反应的始态和终态有关,使用不同的催化 剂,ΔH3 相同,C 项错误;根据盖斯定律,目标反应 CH4(g) C(s)+2H2(g)相当于③- ②,故 ΔH=ΔH3-ΔH2,ΔH=206.1 kJ·mol-1 -131.3 kJ·mol-1=74.8 kJ·mol-1 ,D 项正确。 12.将 1 g H2 与 4 g O2 在点燃条件下充分反应,放出 71.45 kJ 热量。在相同条件 下,1 mol H2 在足量 O2 中完全燃烧放出的热量是( )。 A.71.45 kJ B.142.9 kJ C.571.6 kJ D.285.8 kJ 答案:D 解析:1 g H2 与 4 g O2 反应时,H2 剩余,实际参加反应的 H2为 0.5 g,1 mol H2 的质量 为 2 g,因此 1 mol H2 在 O2 中完全燃烧放出的热量为 71.45 kJ×4=285.8 kJ。 13.已知热化学方程式: ①C2H2(g)+5 2 O2(g) 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1 ②C(s)+O2(g) CO2(g) ΔH2=-393.5 kJ·mol-1 ③H2(g)+1 2 O2(g) H2O(l) ΔH3=-285.8 kJ·mol-1 则反应④2C(s)+H2(g) C2H2(g)的 ΔH 为( )。 A.+228.2 kJ·mol-1 B.-228.2 kJ·mol-1 C.+1 301.0 kJ·mol-1 D.+621.7 kJ·mol-1
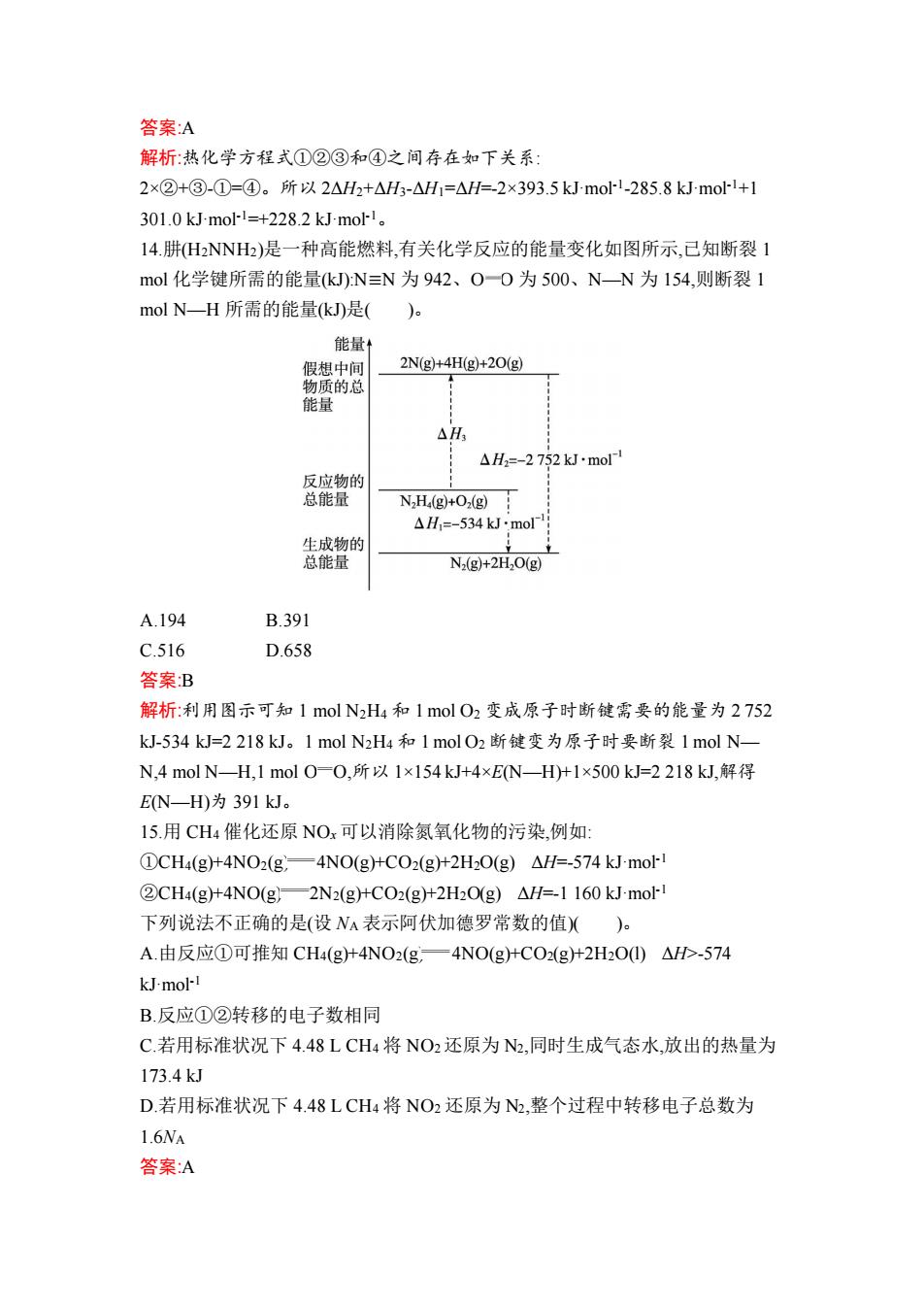
答案:A 解析:热化学方程式①②③和④之间存在如下关系: 2×②+③-①=④。所以2△H2+△H3-△H1=△H=-2×393.5 kJmol-1-285.8 kJ-mol-1+1 301.0kJmo1=+228.2 kJ.mol-1。 14.肼H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,己知断裂1 mol化学键所需的能量(kJ):N≡N为942、O-一0为500、N-N为154,则断裂1 molN一H所需的能量(k是( 能量 假想中间 2N(g)+4H(g)+2O(g) 物质的总 能量 △H △H2=-2752kJ·molr 反应物的 总能量 N2H,(g)+O2(g) △H1=-534 kJ.mol 生成物的 总能量 N2(g)+2H2O(g) A.194 B.391 C.516 D.658 答案B 解析:利用图示可知1molN2H4和1olO2变成原子时断键需要的能量为2752 kJ-534kJ=2218kJ。1molN2H4和1molO2断键变为原子时要断裂1molN一 N,4molN-H,1molO=O,所以1×154kJ+4×EN—H)+1×500kJ=2218kJ,解得 EN—H)为391kJ。 15.用CH4催化还原NOx可以消除氮氧化物的污染,例如 ①CH4(g+4NO2(g,一4NO(gHCO2(g+2HO(g)△H=-574 kJ-mol-1 ②CH4(g+4NO(g)一2N2(g+CO2(g十2HO(g)△H=-1160 kJ-mol-I 下列说法不正确的是(设NA表示阿伏加德罗常数的值)(). A.由反应①可推知CH4(g+4NO2(g,一4NO(g+CO2(g+2H2O0)△HD-574 kJmol-I B.反应①②转移的电子数相同 C.若用标准状况下448LCH4将NO2还原为N2,同时生成气态水,放出的热量为 173.4kJ D.若用标准状况下4.48LCH4将NO2还原为N2,整个过程中转移电子总数为 1.6NA 答案:A
答案:A 解析:热化学方程式①②③和④之间存在如下关系: 2×②+③-①=④。所以 2ΔH2+ΔH3-ΔH1=ΔH=-2×393.5 kJ·mol-1 -285.8 kJ·mol-1+1 301.0 kJ·mol-1=+228.2 kJ·mol-1。 14.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂 1 mol 化学键所需的能量(kJ):N≡N 为 942、O O 为 500、N—N 为 154,则断裂 1 mol N—H 所需的能量(kJ)是( )。 A.194 B.391 C.516 D.658 答案:B 解析:利用图示可知 1 mol N2H4 和 1 mol O2 变成原子时断键需要的能量为 2 752 kJ-534 kJ=2 218 kJ。1 mol N2H4 和 1 mol O2 断键变为原子时要断裂 1 mol N— N,4 mol N—H,1 mol O O,所以 1×154 kJ+4×E(N—H)+1×500 kJ=2 218 kJ,解得 E(N—H)为 391 kJ。 15.用 CH4 催化还原 NOx 可以消除氮氧化物的污染,例如: ①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1 ②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1 下列说法不正确的是(设 NA 表示阿伏加德罗常数的值)( )。 A.由反应①可推知 CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(l) ΔH>-574 kJ·mol-1 B.反应①②转移的电子数相同 C.若用标准状况下 4.48 L CH4 将 NO2还原为 N2,同时生成气态水,放出的热量为 173.4 kJ D.若用标准状况下 4.48 L CH4 将 NO2 还原为 N2,整个过程中转移电子总数为 1.6NA 答案:A