
实验二容量仪器检定【实验目的】1、掌握滴定管、移液管、容量瓶的检定方法2、掌握移液管与容量瓶的相对校准方法,并熟悉校准的意义【实验原理】滴定管,移液管和容量瓶是滴定分析法所用的主要量器。容量器皿的容积与其所标出的体积并非完全相符合。因此,在准确度要求较高的分析工作中,必须对容量器血进行校准。由于玻璃具有热胀冷缩的特性,在不同的温度下容量器血的体积也有所不同。因此,校准玻璃容量器皿时,必须规定一个共同的温度值,这一规定温度值为标准温度。国际上规定玻璃容量器血的标准温度为20℃。既在校准时都将玻璃容量器血的容积校准到20℃时的实际容积。容量器皿常采用两种校准方法。1、相对校准要求两种容器体积之间有一定的比例关系时,常采用相对校准的方法。例如,25mL移液管量取液体的体积应等于250mL容量瓶量取体积的10%。2、绝对校准绝对校准是测定容量器血的实际容积。常用的校准方法为衡量法,又叫称量法。即用天平称得容量器血容纳或放出纯水的质量,然后根据水的密度,计算出该容量器血在标准温度20℃时的实际体积。由质量换算成容积时,需考虑三方面的影响:(1)水的密度随温度的变化(2)温度对玻璃器血容积胀缩的影响(3)在空气中称量时空气浮力的影响为了方便计算,将上述三种因素综合考虑,得到一个总校准值。经总校准后的纯水密度列于表2-1.表 2—1不同温度下纯水的密度值温度/℃密度/(gmL*)温度/℃密度/ (gmL-)0.9984210.997010110.9983220.996816
16 实验二 容量仪器检定 【实验目的】 1、掌握滴定管、移液管、容量瓶的检定方法 2、掌握移液管与容量瓶的相对校准方法,并熟悉校准的意义 【实验原理】 滴定管,移液管和容量瓶是滴定分析法所用的主要量器。容量器皿的容积与其所标出的 体积并非完全相符合。因此,在准确度要求较高的分析工作中,必须对容量器皿进行校准。 由于玻璃具有热胀冷缩的特性,在不同的温度下容量器皿的体积也有所不同。因此, 校准玻璃容量器皿时,必须规定一个共同的温度值,这一规定温度值为标准温度。国际上 规定玻璃容量器皿的标准温度为 20℃。既在校准时都将玻璃容量器皿的容积校准到 20℃时 的实际容积。容量器皿常采用两种校准方法。 1、相对校准 要求两种容器体积之间有一定的比例关系时,常采用相对校准的方法。例如,25mL 移液 管量取液体的体积应等于 250mL 容量瓶量取体积的 10%。 2、绝对校准 绝对校准是测定容量器皿的实际容积。常用的校准方法为衡量法,又叫称量法。即用天平 称得容量器皿容纳或放出纯水的质量,然后根据水的密度,计算出该容量器皿在标准温度 20℃时的实际体积。由质量换算成容积时,需考虑三方面的影响: (1)水的密度随温度的变化 (2)温度对玻璃器皿容积胀缩的影响 (3)在空气中称量时空气浮力的影响 为了方便计算,将上述三种因素综合考虑,得到一个总校准值。经总校准后的纯水密度列 于表 2-1. 表 2—1 不同温度下纯水的密度值 温度/℃ 密度/(g·mL-1) 温度/℃ 密度/(g·mL-1) 10 11 0.9984 0.9983 21 22 0.9970 0.9968

0.9982230.996612 13 0.9981240.996414250.99610.998026150.99790.995927160.99780.9956280.99760.995417 29180.99750.995130 19 0.99730.9948200.9972实际应用时,只要称出被校准的容量器血容纳和放出纯水的质量,再除以该温度时纯水的密度值,便是该容量器血在20 ℃时的实际容积。例 1] 在18℃,某一50mL容量瓶容纳纯水质量为49.87g,计算出该容量瓶在20℃C时的实际容积。解:查表得18℃时水的密度为0.9975gmL=l,所以在20℃时容量瓶的实际容积V20为:49.87 =49.99mlV200.9975【实验仪器与试剂】电子分析天平(千分之一),50mL酸式滴定管,25mL移液管,250mL容量瓶,50mL容量瓶,温度计(0~50℃或0~100℃,公用),洗耳球。【实验步骤】1.酸式滴定管的校正(1)清洗50mL酸式滴定管1支(2)练习并掌握用凡士林涂酸式滴定管活塞的方法和除去滴定管气泡的方法(3)练习正确使用滴定管和控制液滴大小的方法(4)酸式滴定管的校准先将干净并且外部干燥的50mL容量瓶,在台秤上粗称其质量然后在分析天平上称量,准确称至小数点后第二位(0.01g)。将去离子水装满欲校准的酸式滴定管,调节液面至0.00刻度处,记录水温,然后按每分钟约10mL的流速,放出10mL(要求在10mL±0.1mL范围内)水于已称过质量的容量瓶中,盖上瓶塞,再称出它的质量,两次质量之差即为放出水的质量。用同样的方法称量滴定管中从10mL到20mL,20mL到30mL...等刻度间水的质量。用实验温度时的密度除每次得到的水的质量,即可得到滴定管各部分的实际容积。17
17 12 13 14 15 16 17 18 19 20 0.9982 0.9981 0.9980 0.9979 0.9978 0.9976 0.9975 0.9973 0.9972 23 24 25 26 27 28 29 30 0.9966 0.9964 0.9961 0.9959 0.9956 0.9954 0.9951 0.9948 实际应用时,只要称出被校准的容量器皿容纳和放出纯水的质量,再除以该温度时纯水的密度值, 便是该容量器皿在 20℃时的实际容积。 【例 1】 在 18℃,某一 50mL 容量瓶容纳纯水质量为 49.87g,计算出该容量瓶在 20℃时的实际容积。 解:查表得 18℃时水的密度为 0.9975 g·mL −1 ,所以在 20℃时容量瓶的实际容积 V20 为: 20 49.87 V = =49.99mL 0.9975 【实验仪器与试剂】 电子分析天平(千分之一),50mL 酸式滴定管,25mL 移液管,250mL 容量瓶,50mL 容量瓶,温度计 (0~50℃或 0~100℃,公用),洗耳球。 【实验步骤】 1.酸式滴定管的校正 (1)清洗 50mL 酸式滴定管 1 支 (2)练习并掌握用凡士林涂酸式滴定管活塞的方法和除去滴定管气泡的方法 (3)练习正确使用滴定管和控制液滴大小的方法 (4)酸式滴定管的校准 先将干净并且外部干燥的 50mL 容量瓶,在台秤上粗称其质量, 然后在分析天平上称量,准确称至小数点后第二位(0.01g)。将去离子水装满欲校准的酸式 滴定管,调节液面至 0.00 刻度处,记录水温,然后按每分钟约 10mL 的流速,放出 10mL(要 求在 10mL 0.1mL 范围内)水于已称过质量的容量瓶中,盖上瓶塞,再称出它的质量, 两次质量之差即为放出水的质量。用同样的方法称量滴定管中从 10mL 到 20mL,20mL 到 30mL.等刻度间水的质量。用实验温度时的密度除每次得到的水的质量,即可得到滴定 管各部分的实际容积
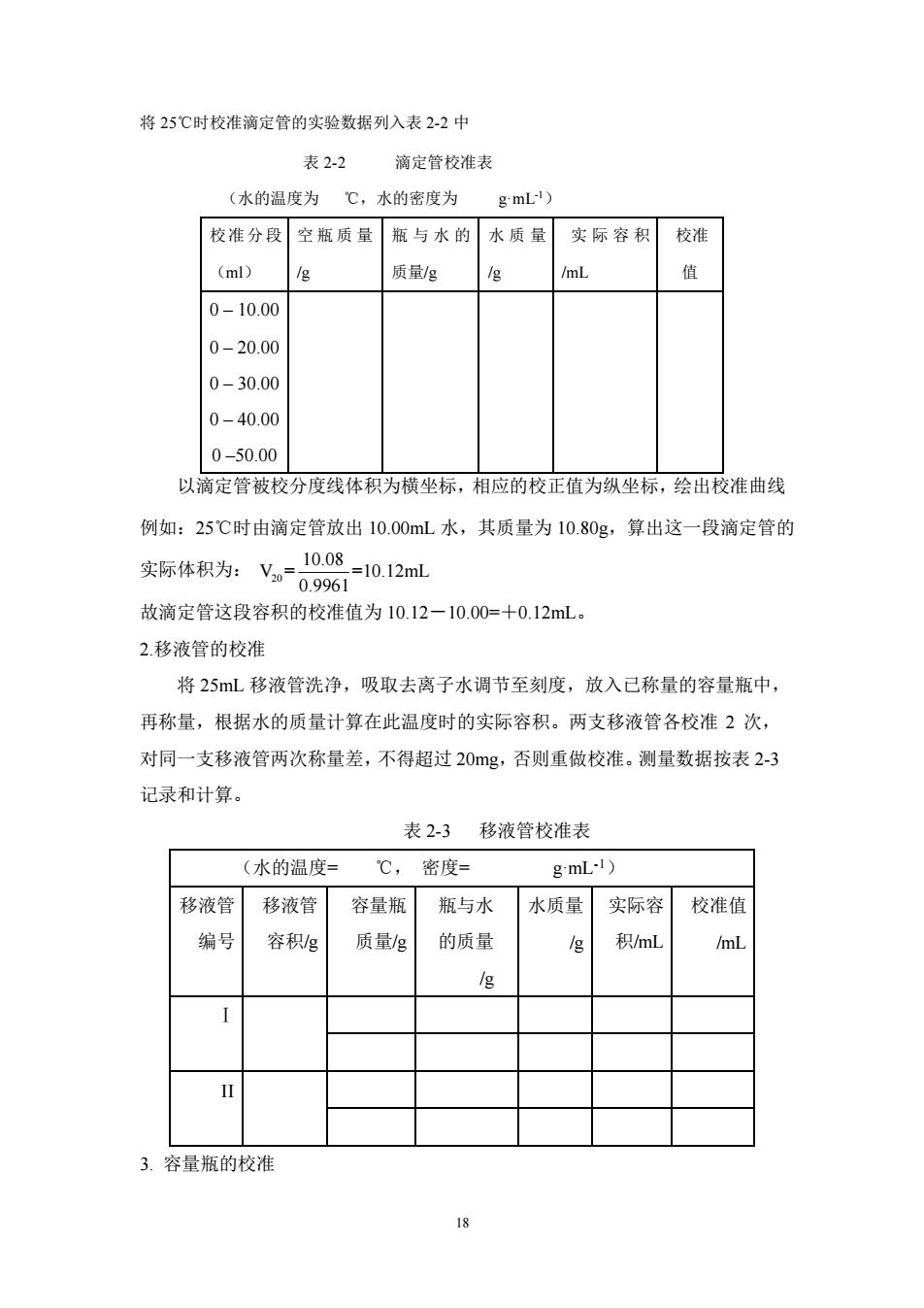
将 25℃时校准滴定管的实验数据列入表2-2中表 2-2滴定管校准表(水的温度为℃,水的密度为g'mL)校准分段 空瓶质量 瓶与水的水质量实际容积校准(ml)质量/g/mL值10/g010.000 20.000 30.000 40.00050.00以滴定管被校分度线体积为横坐标,相应的校正值为纵坐标,绘出校准曲线例如:25℃时由滴定管放出10.00mL水,其质量为10.80g,算出这一段滴定管的10.08=10.12mL实际体积为:V-09961故滴定管这段容积的校准值为10.12—10.00=+0.12mL。2.移液管的校准将25mL移液管洗净,吸取去离子水调节至刻度,放入已称量的容量瓶中,再称量,根据水的质量计算在此温度时的实际容积。两支移液管各校准2次,对同一支移液管两次称量差,不得超过20mg,否则重做校准。测量数据按表2-3记录和计算。表2-3移液管校准表g'mL-1)(水的温度=℃,密度=移液管移液管容量瓶瓶与水水质量实际容校准值编号容积/g质量/g的质量积/mL/mL/g/g1113.容量瓶的校准t
18 将 25℃时校准滴定管的实验数据列入表 2-2 中 表 2-2 滴定管校准表 (水的温度为 ℃,水的密度为 g·mL-1) 校准分段 (ml) 空瓶质量 /g 瓶与水的 质量/g 水质量 /g 实际容积 /mL 校准 值 0 – 10.00 0 – 20.00 0 – 30.00 0 – 40.00 0 –50.00 以滴定管被校分度线体积为横坐标,相应的校正值为纵坐标,绘出校准曲线 例如:25℃时由滴定管放出 10.00mL 水,其质量为 10.80g,算出这一段滴定管的 实际体积为: 20 10.08 V = =10.12mL 0.9961 故滴定管这段容积的校准值为 10.12-10.00=+0.12mL。 2.移液管的校准 将 25mL 移液管洗净,吸取去离子水调节至刻度,放入已称量的容量瓶中, 再称量,根据水的质量计算在此温度时的实际容积。两支移液管各校准 2 次, 对同一支移液管两次称量差,不得超过 20mg,否则重做校准。测量数据按表 2-3 记录和计算。 表 2-3 移液管校准表 (水的温度= ℃, 密度= g·mL-1) 移液管 编号 移液管 容积/g 容量瓶 质量/g 瓶与水 的质量 /g 水质量 /g 实际容 积/mL 校准值 /mL Ⅰ II 3. 容量瓶的校准

用铬酸洗液洗净一个100ml容量瓶,晾干,在电子天平上称准至0.01g。取下容量瓶注水至标线以上几毫米,等待2min。用滴管吸出多余的水,使液面最低点与标线上边缘相切(此时调定液面的作法与使用时有所不同),再放到电子天平上称准至0.01g。然后插入温度计测量水温。两次所称得质量之差即为该瓶所容纳纯水的质量,最后计算该瓶的实际容量。4.容量瓶与移液管的相对校准用25mL移液管吸取去离子水注入洁净并干燥的250mL容量瓶中(操作时切勿让水碰到容量瓶的磨口)。重复10次,然后观察溶液弯月面下缘是否与刻度线相切,若不相切,另做新标记,经相互校准后的容量瓶与移液管均做上相同记号,可配套使用。【思考题】1.称量水的质量时,为什么只要精确至0.01g?2.为什么要进行容器器血的校准?影响容量器血体积刻度不准确的主要因素有哪些?3.利用称量水法进行容量器血校准时,为何要求水温和室温一致?若两者有稍微差异时,以哪一温度为准?4.从滴定管放去离子水到称量的容量瓶内时,应注意些什么?5.滴定管有气泡存在时对滴定有何影响?应如何除去滴定管中的气泡?6.使用移液管的操作要领是什么?为何要垂直流下液体?为何放完液体后要停定时间?最后留于管尖的液体如何处理?为什么??实验三氯化钡结晶水的测定【实验目的】1.掌握间接重量法测定水分的原理和方法。2.进一步熟悉分析天平的正确称量方法。【实验原理】19
19 用铬酸洗液洗净一个 100ml 容量瓶,晾干,在电子天平上称准至 0.01g。取下容 量瓶注水至标线以上几毫米,等待 2min。用滴管吸出多余的水,使液面最低点与标 线上边缘相切(此时调定液面的作法与使用时有所不同),再放到电子天平上称准 至 0.01g。然后插入温度计测量水温。两次所称得质量之差即为该瓶所容纳纯水的质 量,最后计算该瓶的实际容量。 4. 容量瓶与移液管的相对校准 用 25mL 移液管吸取去离子水注入洁净并干燥的 250mL 容量瓶中(操作时切勿让水 碰到容量瓶的磨口)。重复 10 次,然后观察溶液弯月面下缘是否与刻度线相切, 若不相切,另做新标记,经相互校准后的容量瓶与移液管均做上相同记号,可配 套使用。 【思考题】 1. 称量水的质量时,为什么只要精确至 0.01g? 2. 为什么要进行容器器皿的校准?影响容量器皿体积刻度不准确的主要因素有 哪些? 3. 利用称量水法进行容量器皿校准时,为何要求水温和室温一致?若两者有稍微 差异时,以哪一温度为准? 4. 从滴定管放去离子水到称量的容量瓶内时,应注意些什么? 5. 滴定管有气泡存在时对滴定有何影响?应如何除去滴定管中的气泡? 6. 使用移液管的操作要领是什么?为何要垂直流下液体?为何放完液体后要停 一定时间?最后留于管尖的液体如何处理?为什么?? 实验三 氯化钡结晶水的测定 【实验目的】 1.掌握间接重量法测定水分的原理和方法。 2.进一步熟悉分析天平的正确称量方法。 【实验原理】

干燥失重法常用于固体试样中水分、结晶水或其他易挥发组分的含量测定。将试样放入电热干燥箱中进行常压加热,提高试样内部水的蒸气压,试样中的水分就向外扩散,达到干燥脱水的目的。存在于物质中的水分一般有两种形式:一种是吸湿水,另一种是结晶水。吸湿水是物质从空气中吸收的水,其含量随空气中的湿度而改变,一般在不太高的温度下即能除掉。结晶水是水合物内部的水,它有固定的质量,可以在化学式中表示出来。例如,Na2CO3-10H20;CuSO4-5H20;BaCh?2H2O等,均可测定其中结晶水的含量。例如,结晶氯化钡中结晶水含量的测定:BaCh-2H20中的结晶水,在105℃时能完全挥发失去:BaCl, 2H,0→BaCl, +2H,0个而无水BaCl2在1073K~1173K(800~900℃),甚至更高温度下,也不分解和挥发。称取一定质量的结品氯化钡,在上述温度下加热到质量不再改变时为止,试样减轻的质量就等于结晶水的质量。【实验仪器与试剂】电热恒温干燥箱:101-2型电热鼓风干燥箱,50~300℃,上海沪南科学仪器厂;电子天平,上海天平仪器厂;称量瓶;干燥器。BaChz-2H20 (AR) 。【实验步骤】取两只洗净的扁形称量瓶,在干燥箱中于105℃开盖烘干1小时,取出放于干燥器内冷却30min,在分析天平上称量。然后重复在干燥箱中于105℃烘干1h,冷却、称量,直至恒重为止。两次称量之差不超过0.3mg即为恒重,记为m克。取氯化钡样品约1g,平铺在上述恒重的称量瓶中,精密称取,记为m,克。将盛有BaCh2-2H2O样品的称量瓶开盖,将盖斜靠瓶口放在干燥箱中逐渐升温,于105℃烘干1h,取出打开瓶盖,放在干燥器冷却30min,准确称重。然后重复以上操作,直至恒重为止,记为m,克。由加热前称量瓶和样品的质量,减去加热后称量瓶和无水氯化钡的质量,即为失去水分的质量。结晶水的质量分20
20 干燥失重法常用于固体试样中水分、结晶水或其他易挥发组分的含量测 定。将试样放入电热干燥箱中进行常压加热,提高试样内部水的蒸气压,试样中 的水分就向外扩散,达到干燥脱水的目的。 存在于物质中的水分一般有两种形式:一种是吸湿水,另一种是结晶水。吸湿 水是物质从空气中吸收的水,其含量随空气中的湿度而改变,一般在不太高的温 度下即能除掉。结晶水是水合物内部的水,它有固定的质量,可以在化学式中表 示出来。例如,Na2CO3·10H2O ;CuSO4·5H2O ;BaCl2·2H2O 等,均可测定其中 结晶水的含量。例如,结晶氯化钡中结晶水含量的测定: BaCl2·2H2O 中的结晶水,在 105℃时能完全挥发失去: ⎯→ + BaCl2 2H2O BaCl2 2H2O 而无水 BaCl2 在 1073K~1173K(800~900℃),甚至更高温度下,也不分 解和挥发。称取一定质量的结晶氯化钡,在上述温度下加热到质量不再改变时为 止,试样减轻的质量就等于结晶水的质量。 【实验仪器与试剂】 电热恒温干燥箱:101-2 型电热鼓风干燥箱,50~300℃,上海沪南科学仪器厂; 电子天平,上海天平仪器厂;称量瓶;干燥器。 BaCl2·2H2O(AR)。 【实验步骤】 取两只洗净的扁形称量瓶,在干燥箱中于 105℃开盖烘干 1 小时,取出放于 干燥器内冷却 30min,在分析天平上称量。然后重复在干燥箱中于 105℃烘干 1h , 冷却、称量,直至恒重为止。两次称量之差不超过 0.3mg 即为恒重,记为 m1 克。 取氯化钡样品约 1g,平铺在上述恒重的称量瓶中,精密称取,记为 m2 克。 将盛有 BaCl2·2H2O 样品的称量瓶开盖,将盖斜靠瓶口放在干燥箱中逐渐升 温,于 105℃烘干 1h,取出打开瓶盖,放在干燥器冷却 30min ,准确称重。然 后重复以上操作,直至恒重为止,记为 m3 克。由加热前称量瓶和样品的质量, 减去加热后称量瓶和无水氯化钡的质量,即为失去水分的质量。结晶水的质量分