
氧化还原反应进行的完全 问题三: 程度和什么有关?
问题三: 氧化还原反应进行的完全 程度和什么有关?
第二节 氧化还原反应进行的程度 条件平衡常数K? Ox2 n2 e Red, aOx +bRed,aRed+bOx2 02=pg+0.059 C02 Cped con)c n2 K= CRedz 设n为两电对电子转移数 n1、n2的最小公倍数,得到: Ox1+nje Red n n 0.059 一 n2= 01=p1+ a b n 得失电子数应相等! 最为理3大孝 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOG
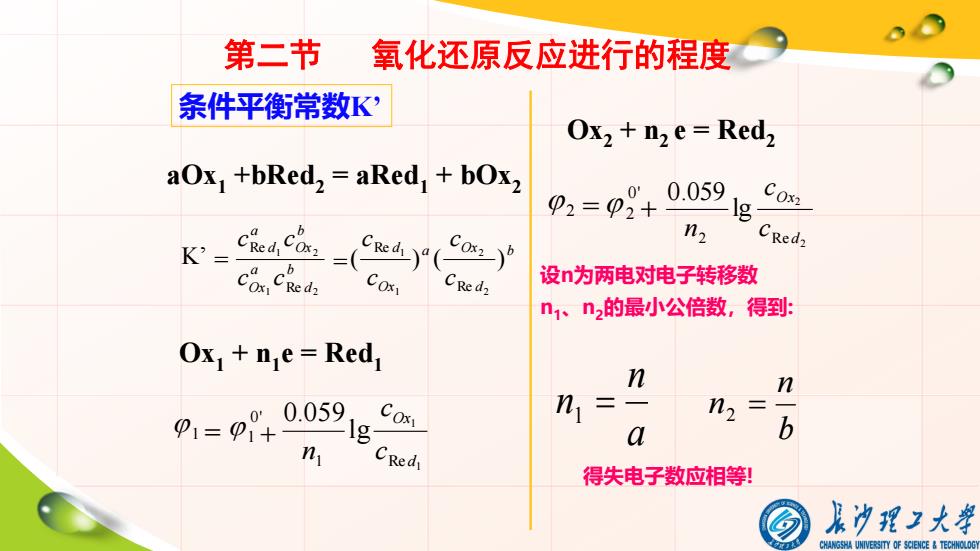
条件平衡常数K’ aOx1 +bRed2 = aRed1 + bOx2 b d a Ox b Ox a d c c c c 1 2 1 2 Re Re b d a Ox Ox d c c c c ( ) ( ) 2 2 1 1 Re Re K’ = = Ox1 + n1 e = Red1 1 0' 1 1 1 1 Re lg 0.059 d Ox c c n = + Ox2 + n2 e = Red2 2 0' 2 2 2 2 Re lg 0.059 d Ox c c n = + 设n为两电对电子转移数 n1、n2的最小公倍数,得到: a n n1 = b n n2 = 得失电子数应相等! 第二节 氧化还原反应进行的程度

反应平衡(化学计量点)时: 01=p2 p4 0.059 Com=o+ COxz n 0.039 整理,得: 1gk-o”-gn 或 lgK= (p°-pg)n 0.059 0.059 展为理3大舞 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOG
反应平衡(化学计量点)时: 1 = 2 0' 1 1 1 1 Re lg 0.059 d Ox c c n + = 2 2 2 Re lg 0.059 d Ox c c n 0' 2 + 整理,得: 0.059 ( ) 0' 2 0' 1 − n lgK’ = 0.059 ( ) 0 2 0 1 − n 或 lgK=

氧化还原反应进行的程度可以用平衡常数K来衡量。 其与有关电对的标准电极电位有关。 1、公式 logk=m-o) 0.059V 某一氧化还原反应,为定值,两电对的条件电位之差 愈大,K愈大,反应进行的越完全。 2、滴定分析的判据:对于1=n2=1的反应,则 为什么? logK>6 集为理2大孝 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOG
氧化还原反应进行的程度可以用平衡常数K来衡量。 其与有关电对的标准电极电位有关。 1、公式 某一氧化还原反应,n为定值,两电对的条件电位之差 愈大,K 愈大,反应进行的越完全。 2、滴定分析的判据:对于n1 =n2=1的反应,则 logK≥6 V n K 0.059 ( ) log ' ' 2 ' 1 − = 为什么?

3滴定反应$P时:滴定反应的完全度应>99.9% >1:1型反应 Ox +Red,Red+Oxz 应满足 Ce4≥1032 C0210 C04 CRed: CRed,Cox2≥105 CoxCRed logK=m-o) 0.059V →A0=m-pg=0059 gK'≥ 0.059×6 0.36v n h=h=1→△0=0-og≥0.36V n=n2=2→△0'=p9-p5≥0.18y 沙理3大舞 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOG
3.滴定反应SP时:滴定反应的完全度应 > 99.9% ➢ 1:1型反应 6 Re Re ' 10 1 2 1 2 = Ox d d Ox C C C C K V n n K n 0.059 6 0.36 lg ' 0.059 ' ' 2 ' 1 = = − = n n 1 ' 0.36V ' 2 ' 1 = 2 = = 1 − n n 2 ' 0.18V ' 2 ' 1 = 2 = = 1 − Ox1 +Red2 = Red1 + Ox2 V n K 0.059 ( ) log ' ' 2 ' 1 − =