
第四章萃取 第一节概述 Extraction 11更义 苏海传 深背瓷整赛科到袍毫魏吸的分季数价 1-2分與 至少有一相为流体,即为草取剂(Extractant) 分 物的科 1-3革取燥作的几个程 根据率取荆种类和形式不同: 澄清过程:分散的液滴藏聚合并,形成两相。 (简称剂草取 溶再生:多来用燕馏或反取 l-4反華取(Back extraction) 15应用围 反苯取: 口液体混合物中相对挥发度a1,精馏操作不经 [萃取完成后→→→纯化同标产物或下一步分离 济 制药、食品、生物产品】 洗漆操作: 口液体混合物中含有较多气化潜热很大的岛椰 腐诗透系到有教湘的条质,提高反苹浅中目标产物 亮桃念:而板命又不走用棉物,林排排林中
1 第四章 萃取 (Extraction) 苏海佳 生化分离工程 第四章 第四章 | 萃取:溶质在互不相溶的两相之间分配系数的 不同而使溶质得到纯化或浓缩的方法。 1-1 定义 生化分离工程 第四章 第四章 | 1-2 分类 至少有一相为流体,即为萃取剂(Extractant) 根据萃取剂种类和形式不同: 分类 萃取剂 目标物的原料 液液萃取 液 液 固液萃取或浸取(leaching)液 固 超临界萃取 超临界流体 固或液 生化分离工程 第四章 第四章 | 根据萃取剂种类和形式不同: 有机溶剂萃取(简称溶剂萃取) 液液萃取 双水相萃取 液膜萃取 反胶团萃取 1-3 萃取操作的几个过程 混合过程:原料液和萃取剂充分接触,各组分 发生不同程度的相际转移,进行质量传递。 生化分离工程 第四章 第四章 | 澄清过程:分散的液滴凝聚合并,形成两相。 溶剂再生:多采用蒸馏或反萃取。 1-4 反萃取(Back extraction) 萃取完成后纯化目标产物或下一步分离 调节水相条件,将目标产物从有机相转 入水相的萃取操作。 反萃取: 生化分离工程 第四章 第四章 | 除去萃取到有机相的杂质,提高反萃液中目标产物 的纯度。 洗涤操作: 1-5 应用范围 液体混合物中相对挥发度α≈1,精馏操作不经 济 液体混合物在蒸馏时出现恒沸物; 热敏性物料,加热易分解、聚合或变性,如 生化分离工程 第四章 第四章 | 制药、食品、生物产品。 液体混合物中含有较多气化潜热很大的易挥 发组分,而组分又不是目标物,精馏操作中 能耗大
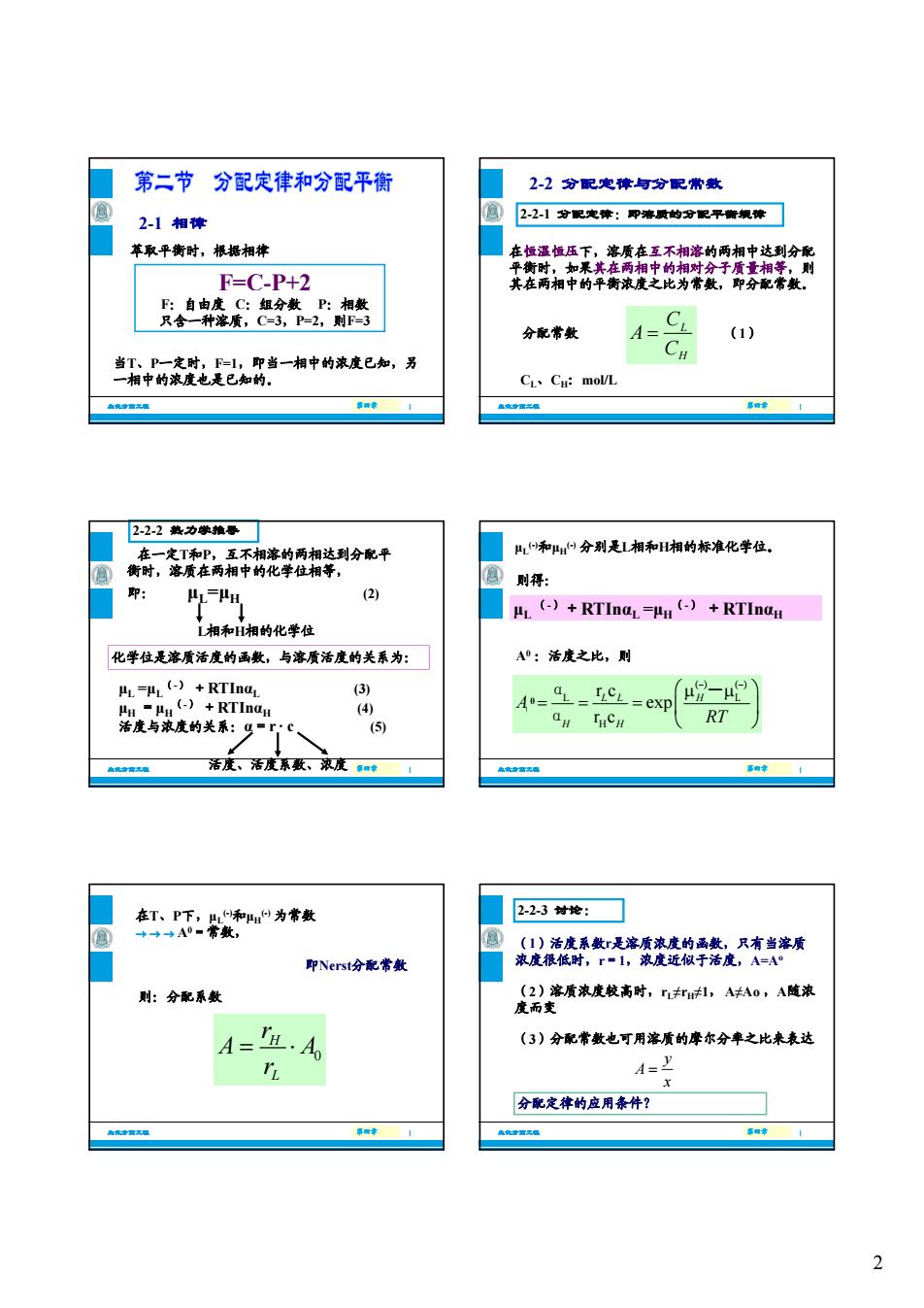
第二节分配定律和分配平衡 2-2分配定律与分配常数 21相德 2-2,1分配克障:即溶受的分配平衡规障 草取平衡时,根搭相 F=D42 平相中的 及降: 分配常数 (1) 盖有中的资比一湘中的冰成已加,为 C、C:molL 2-22热力噪推票 分别是湘和H湘的标准化学位。 国则得: HL HH (2 相和H相的化学位 化学位是溶质活度的画戴,与溶质活度的关系为: A:活度之比,则 .-BL()+RTIna. (3) aM THCH RT 活度、活度东数、浓度中 在却T:为常货 ■223材e:☐ 即Nersta分配常数 促产吸盛检手醛有美客质 则:分配系数 设生项我度段高时,,A0,A道流 A=且.A (3)分配常数也可用溶质的摩尔分率之比来表达 A=2 分配定律的应用泰件? 2
2 2-1 相律 F=C-P+2 萃取平衡时,根据相律 生化分离工程 第四章 第四章 | F:自由度 C:组分数 P:相数 只含一种溶质,C=3,P=2,则F=3 当T、P一定时,F=1,即当一相中的浓度已知,另 一相中的浓度也是已知的。 在恒温恒压下,溶质在互不相溶的两相中达到分配 平衡时,如果其在两相中的相对分子质量相等,则 其在两相中的平衡浓度之比为常数,即分配常数。 2-2 分配定律与分配常数 2-2-1 分配定律:即溶质的分配平衡规律 生化分离工程 第四章 第四章 | L H C A C CL、CH:mol/L 分配常数 (1) L相和H相的化学位 在一定T和P,互不相溶的两相达到分配平 衡时,溶质在两相中的化学位相等, 即: μL=μH (2) 化学位是溶质活度的函数,与溶质活度的关系为: 2-2-2 热力学推导 生化分离工程 第四章 第四章 | μL =μL (-) +RTInαL (3) μH =μH (-) +RTInαH (4) 活度与浓度的关系:α=r · c (5) 化学位是溶质活度的函数,与溶质活度的关系为: 活度、活度系数、浓度 μL (-)和μH (-) 分别是L相和H相的标准化学位。 μL (-)+RTInαL =μH (-) +RTInαH A0 :活度之比,则 则得: 生化分离工程 第四章 第四章 | A0 :活度之比,则 L 0 H r c exp r c LL H H H A RT (-) (-) α - L α 0 则:分配系数 在T、P下,μL (-)和μH (-) 为常数 A0=常数, 即Nerst分配常数 生化分离工程 第四章 第四章 | 0 H L r A A r 2-2-3 讨论: (1)活度系数r是溶质浓度的函数,只有当溶质 浓度很低时,r=1,浓度近似于活度,A=Ao (2)溶质浓度较高时,rL≠rH≠1, A≠Ao ,A随浓 度而变 生化分离工程 第四章 第四章 | (3)分配常数也可用溶质的摩尔分率之比来表达 y A x 分配定律的应用条件?
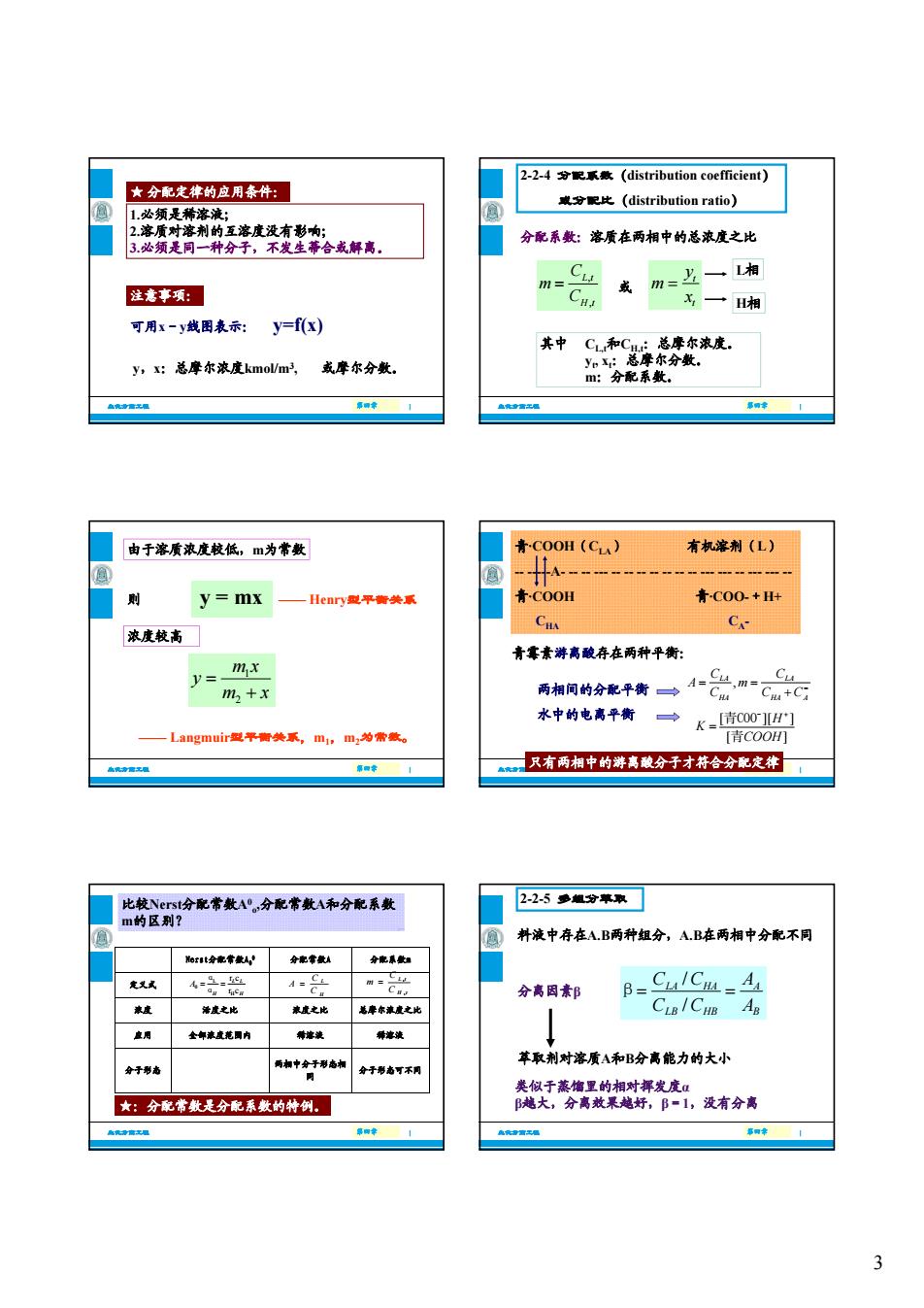
★分配走律的应用泰件: k分起比(distribution ratio) 分配系数:溶质在两相中的总浓度之比 注意事项: mC 或m=上一湘 x一H相 可用x-y线围表示:y=f(x) 其中C和C y,:总摩尔浓度kmol/m,或摩尔分数。 m:分配系数 由于溶质浓度校低,m为常数 青CO0H(C) 有机津荆(L) 则 y=mx Henn要平衡关系 青C00H 青C00++ C C- 来度較高 青素游高酸存在两种平衡: m.x y=m+x 两相同的分配平衡一4=兴m 水中的电高牛→K- 只有两相中的游离酿分子才符合分定 配常A分配常数A不分配系数 225●题分草取 的区别? 补液中存在AB两种组分,AB在两相中分配不同 分高因素邦 B 苹取剂对溶质A和B分高能力的大小 :分配常数分配系数的特创。 泰于透的对度,凌有合高 3
3 1.必须是稀溶液; 2.溶质对溶剂的互溶度没有影响; 3.必须是同一种分子,不发生蒂合或解离。 ★ 分配定律的应用条件: 注意事项: 生化分离工程 第四章 第四章 | 可用x-y线图表示: y=f(x) y,x:总摩尔浓度kmol/m3, 或摩尔分数。 2-2-4 分配系数(distribution coefficient) 或分配比(distribution ratio) 分配系数:溶质在两相中的总浓度之比 CL t, m C 或 t y m L相 生化分离工程 第四章 第四章 | CH t, 或 t x 其中 CL,t和CH,t:总摩尔浓度。 yt , xt :总摩尔分数。 m:分配系数。 H相 则 由于溶质浓度较低,m为常数 浓度较高 y = mx —— Henry型平衡关系 生化分离工程 第四章 第四章 | 1 2 m x y m x —— Langmuir型平衡关系,m1,m2为常数。 青·COOH(CLA) 有机溶剂(L) -- -----A- -- -- --- -- -- -- -- -- -- -- --- --- -- --- --- -- 青·COOH 青·COO-+H+ CHA CA- 青霉素游离酸存在两种平衡: 生化分离工程 第四章 第四章 | 青霉素游离酸存在两种平衡: 两相间的分配平衡 水中的电离平衡 , LA LA HA HA A C C A m C CC [ ][ ] [ ] H K COOH 青COO- 青 只有两相中的游离酸分子才符合分配定律 L 0 H r c r c L L H H A α α L H C A C , , L t H t C m C 浓度 活度之比 浓度之比 总摩尔浓度之比 定义式 Nerst分配常数A 分配常数A 分配系数m 0 0 比较Nerst分配常数A0 o,分配常数A和分配系数 m的区别? 生化分离工程 第四章 第四章 | ★:分配常数是分配系数的特例。 分子形态可不同 两相中分子形态相 同 分子形态 应用 全部浓度范围内 稀溶液 稀溶液 2-2-5 多组分萃取 料液中存在A.B两种组分,A.B在两相中分配不同 分离因素β / / LA HA A LB HB B CC A CC A β 生化分离工程 第四章 第四章 | 类似于蒸馏里的相对挥发度α β越大,分离效果越好,β=1,没有分离 萃取剂对溶质A和B分离能力的大小
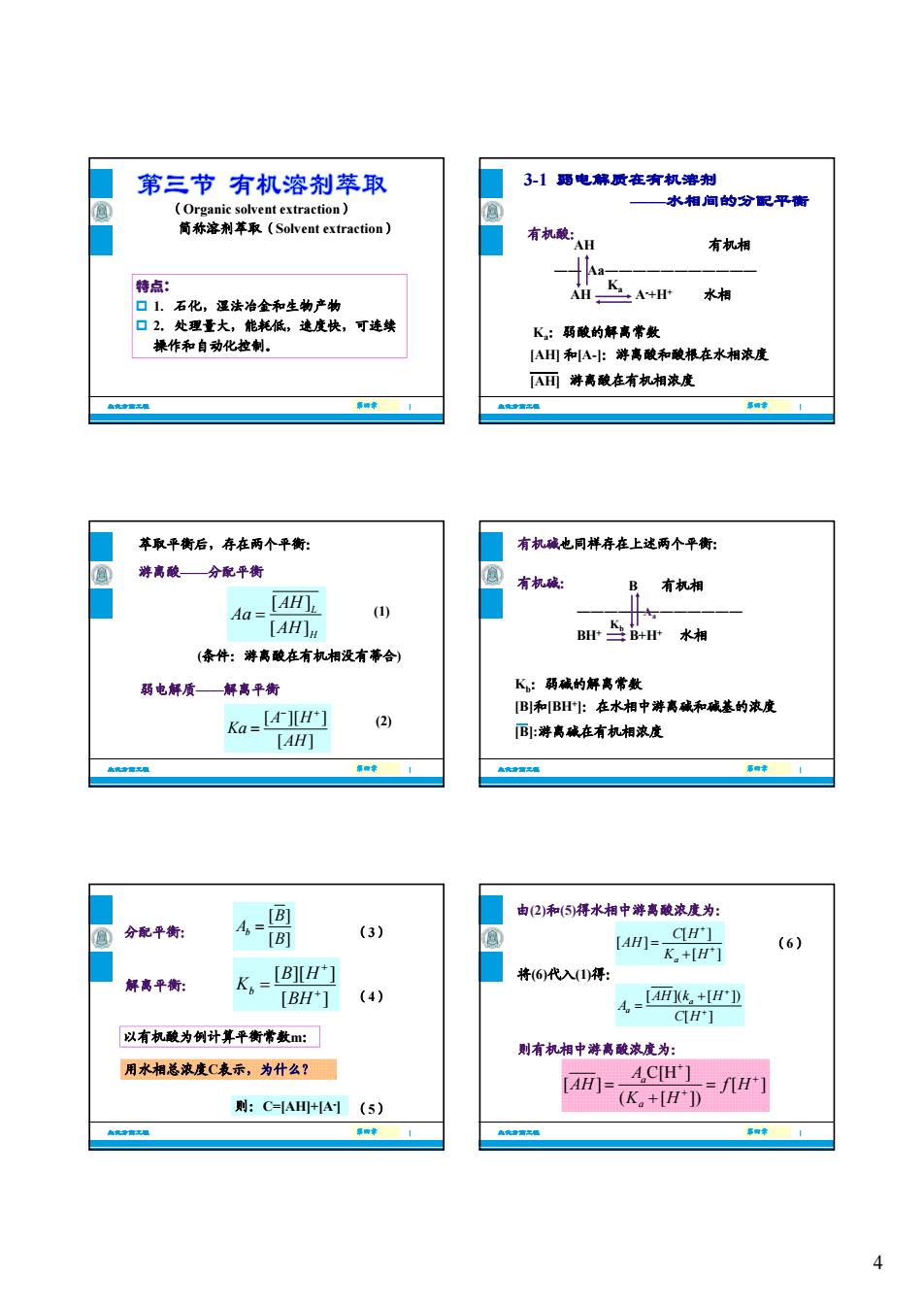
第三节有机溶剂萃取 3-1用电解质在有机塘荆 水相间的分配平衡 有机政A 有机湘 特点: KA+水相 口2处理量 K:药酸的解高常数 操作和自动化拉制。 A田和A:游离酸和被根在水相浓度 A而游离酸在有机相浓度 苹取平衡后,存在两个平衡: 有机碱也同样存在上递两个平衡: 游高酸—分配平街 B有机湘 Aa-气An 「AHI1. ) B上B+r水相 (条件:游高酸在有机湘没有蒂合) 弱电解质—解离平衡 Ko-] [B吲和BF上在水湘中游离碱遂的滚废 B:游离碱在有机相浓度 AF 由2)和(5得水相中游离酸浓度为: 分配平衡: (3) 【4H]-K。+F CIH'1 (6) 解离平衡: K.-[B) 将6代入山得: [BH+](4) 以有机酸为例计算平衡常数m: 则有机湘中游离酸度为: 用水相总浓度C表示,为什么?☐ AH)= AC门 则:C-AH用+HA(5) (K。+H) =几H
4 特点: 简称溶剂萃取(Solvent extraction) (Organic solvent extraction) 生化分离工程 第四章 第四章 | 特点: 1. 石化,湿法冶金和生物产物 2.处理量大,能耗低,速度快,可连续 操作和自动化控制。 3-1 弱电解质在有机溶剂 ——水相间的分配平衡 有机酸:AH 有机相 ―― Aa――――――――――― AH A H+ 水相 Ka 生化分离工程 第四章 第四章 | Ka:弱酸的解离常数 [AH] 和[A-]:游离酸和酸根在水相浓度 游离酸在有机相浓度 AH A- +H+ 水相 a [AH] 萃取平衡后,存在两个平衡: 游离酸——分配平衡 [ ] [ ] L H AH Aa AH (条件:游离酸在有机相没有蒂合) (1) 生化分离工程 第四章 第四章 | (条件:游离酸在有机相没有蒂合) 弱电解质——解离平衡 [ ][ ] [ ] A H Ka AH (2) 有机碱也同样存在上述两个平衡: 有机碱: B 有机相 ―――――――――――― BH+ B+H+ 水相 Kb Aa 生化分离工程 第四章 第四章 | Kb:弱碱的解离常数 [B]和[BH+]:在水相中游离碱和碱基的浓度 [B]:游离碱在有机相浓度 分配平衡: 解离平衡: [ ] [ ] b B A B [ ][ ] [ ] b B H K BH (3) (4) 生化分离工程 第四章 第四章 | 用水相总浓度C表示,为什么? 以有机酸为例计算平衡常数m: 则:C=[AH]+[A- ] (5) 由(2)和(5)得水相中游离酸浓度为: [ ] [ ] [ ] a C H AH K H 将(6)代入(1)得: [ ]( [ ]) [ ] a a AH k H A C H (6) 生化分离工程 第四章 第四章 | C H[ ] 则有机相中游离酸浓度为: + C[H ] [ ] [] ( [ ]) a a A AH fH K H

则游离酸的分配系数: 则游离碱的分配系数m为: ®品p =x+阿p 两边取对数: 四会 周理可得有机湘中游离碱的浓度为: @会气小-成-p 作业:推导公式↑ 3-2化苹取平衡 K CHOO台RCHCOO+H 氯遂收 -ur]0) A () 桌基酿解离平衡 K,和K,为解离常数 AA,和A表示偶板高子,阳离于和朋离于型基酸 积 (1) 几。阴高学变热菜取村 (r)(o 三辛基甲候(记作 则可推导出: K.-IFIcT 【AI[R'Cr] m,=Km+,W工 (6) K:KK2 基酿表观☆配系 m,=R C=[A]+[A]+[A C表观分配系数 3
5 则游离酸的分配系数m: 两边取对数: [ ] [ ] ( ) ( [ ]) a a a AH A H m f pH C KH log[ 1] a a A pH pK pKa=-logKa 生化分离工程 第四章 第四章 | g[ ] a a p p m p a= g a 同理可得有机相中游离碱的浓度为: CKb [] [ ] ( [ ]) b b A B fH K H [ ] b b b b KH A K m ( ) [ ] b b b b K m A f pH K H 则游离碱的分配系数mb为: 生化分离工程 第四章 第四章 | log( 1) b b b A pK pH m 作业:推导公式 3-2 化学萃取平衡 氨基酸 萃取剂:季铵盐类(氯化三辛基甲铵) 磷酸酯类(二(2-乙基己基)磷酸) 氨基酸解离平衡 生化分离工程 第四章 第四章 | 1 3 3 ( )() K RCHOOH RCHCOO H NH NH A A 1 [ ][ ] [ ] A H K A (1) (2) 2 [ ][ ] [ ] A H K A K1和K2为解离常数 ( ) ( ) 3 2 2 A A NH NH RCHOO RCHCOO H K (A) (A- ) 生化分离工程 第四章 第四章 | 采用阴离子型萃取剂,氯化三辛基甲铵(记作 R+Cl- ),萃取阴离子氨基酸 A,A+,和A- 表示偶极离子,阳离子和阴离子型氨基酸 1. 阴离子交换萃取剂 [ ][ ] [ ][ ] Kecl ecl R Cl A R A Cl R A Cl K A R Cl (3) 氨基酸表观分配系数 [ ] A A R A m C (4) 生化分离工程 第四章 第四章 | [ ][ ][] CA A A A [ ] [ ] cl R Cl m Cl Cl (5) - 表观分配系数 则可推导出: 2 1 2 12 [ ][ ] (1 ) A ecl cl H H m Km K KK 阴离子氨基酸的离子交换反应需高于其等电点的 pH范围内进行,故[A+]≈0 (6) 生化分离工程 第四章 第四章 | p 范围内进行,故[ ] 上式简化为: ( ) [ ] 2 2 f pH K H K mA Keclmcl