
例题 某容器中含有NL、O2、N等气体的混合物。 取样分析后,其中n(N)=0.320mo1,n(02) =0.180mo1,n(N2)=0.700mo1。混合气体的总压 133.0kPa。试计算各组分气体的分压。 解:n=n(NH)+n(02)+n(N2) =0.320mo1+0.180mo1+0.700mo1 =1.200mo1 p0,)=0 p(N2)=p-p(NH3)-p(O2) n =(133.0-35.5-20.0)kPa 0.180 ×35.5kPa=20.0kPa 0.320 =77.5kPa
例题 某容器中含有NH3、O2 、N2等气体的混合物。 取 样 分析 后, 其中 n (NH3 )=0.320mol, n(O2 ) =0.180mol ,n(N2 )=0.700mol。混合气体 的总压 p=133.0kPa。试计算各组分气体的分压。 解:n= n(NH3)+n(O2)+n(N2) =0.320mol+0.180mol+0.700mol =1.200mol p(N2 )= p- p(NH3 ) - p(O2 ) =(133.0-35.5-20.0)kPa =77.5kPa ( ) ( 2 ) 2 O O 0.180 35.5kPa 20.0kPa 0.320 n p p n = = =
3分压定律的应用 盐酸 氢和水蒸气的混合气体 锌粒 水(20℃)
3 分压定律的应用

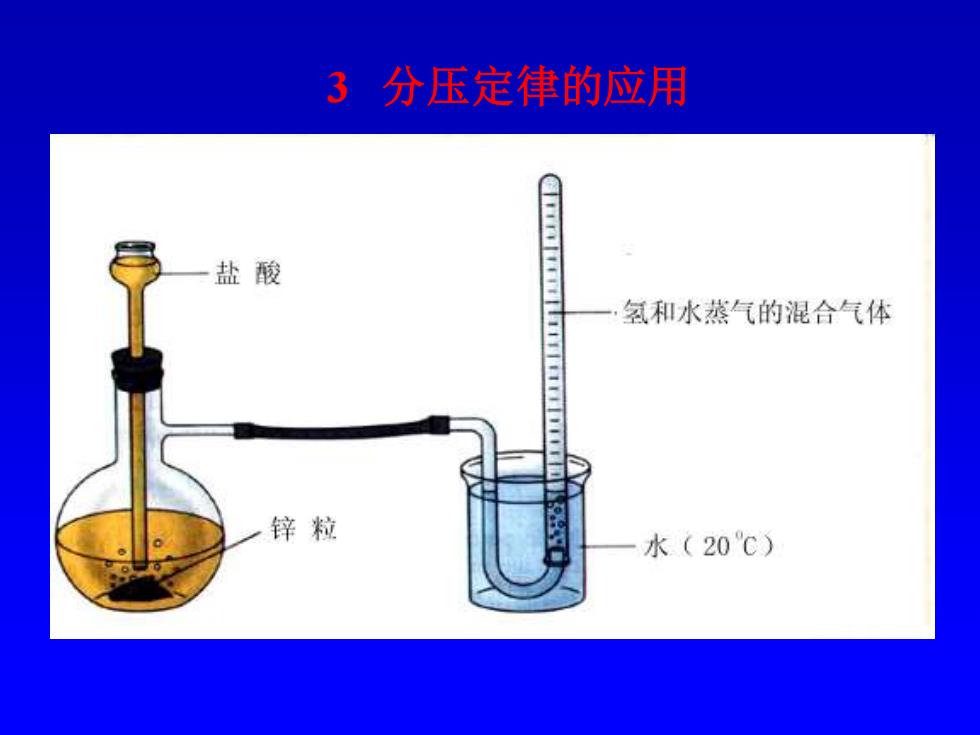
例题:可以用亚硝酸铵受热分解的方法制取纯氮气。反应 如下: NH4N02(s)→2H20(g)+N2(g) 如果在19℃、97.8kPa下,以排水集气法在水面上收集到的 氮气体积为4.16L,计算消耗掉的亚硝酸铵的质量。 解:I=(273+19)K=292K p=97.8kPa 4.16L 292K时,p(H0)=2.20kPa M(NH4N02)=64.04
例题: 可以用亚硝酸铵受热分解的方法制取纯氮气。反应 如下: NH4NO2(s) ⎯→2H2O(g) + N2(g) 如果在19℃、97.8kPa下,以排水集气法在水面上收集到的 氮气体积为4.16L,计算消耗掉的亚硝酸铵的质量。 解:T=(273+19)K=292K p=97.8kPa V=4.16L 292K 时,p(H2O)=2.20kPa Mr (NH4NO2)=64.04

(97.8-2.20)kPa×4.16L nN2尸 8.314J.K-.mol×292K =0.164mol NH4NO2(S)→2H2O(g)+ N2(g) 64.04g 1mol m(NHNO2=? 0.164mol m(NHANO2)= 64.04g×0.164mol 1mol =10.5g
n(N2 )= =0.164mol NH4NO2 (s) ⎯→ 2H2O(g) + N2 (g) 64.04g 1mol m(NH4NO2 )=? 0.164mol m(NH4NO2 )= =10.5g 8 314J K mol 292K (97 8 2 20)kPa 4.16L -1 -1 − . . . 1mol 64.04g0.164mol

*4分体积定律 分体积: 混合气体中某一组分B的分体积V,是该组份单独存在 并具有与混合气体相同温度和压力时所占有的体积
*4 分体积定律 分体积: 混合气体中某一组分B的分体积VB是该组份单独存在 并具有与混合气体相同温度和压力时所占有的体积。 p n RT V B B =