
2.共价键的类型 8米·懿 8·98·w P一dr键及d一dπ键的形成
P-dπ键及d- dπ键的形成

2.共价键的类型 01 键电子云的分布以核间联线呈园柱形对 称,兀键电子云的分布以键为对称面的上下两 部分。由于σ键实现了原子轨道的最大重叠, 而键中原子轨道的重叠程度要小得多,'。0 键较牢固,兀键牢固性较差易断裂。 刷 离
σ键电子云的分布以核间联线呈园柱形对 称,π键电子云的分布以键为对称面的上下两 部分。由于σ键实现了原子轨道的最大重叠, 而π键中原子轨道的重叠程度要小得多,∴σ 键较牢固,π键牢固性较差易断裂

2.共价候的美型6能 一个原子的d轨道与另一个原子相匹配 的d轨道(例如dxy与dxy)以“面对面”的 方式重叠(通过键轴有两个节面),形成 的键就称为δ键 图7-7由两个dy轨道重叠而成的δ轨道 K>I
一个原子的d轨道与另一个原子相匹配 的d轨道(例如dxy与dxy)以“面对面”的 方式重叠(通过键轴有两个节面),形成 的键就称为δ键

2.共价健的美型—配位健 如果共价键的形成是由成键两原子中的 一个原子单独提供电子对,与另一个原子 的空轨道重叠,共用电子对而形成的共价 键称为配位共价键(coordinate covalent bond)',简称配位键(coordination bond) 要形成配位键必须同时具备两个条件: 1)一个成键原子的价电子层有孤对电子; 2)另一个成键原子的价电子层有空轨道
如果共价键的形成是由成键两原子中的 一个原子单独提供电子对,与另一个原子 的空轨道重叠,共用电子对而形成的共价 键称为配位共价键(coordinate covalent bond),简称 配位键(coordination bond)。 要形成配位键必须同时具备两个条件: 1)一个成键原子的价电子层有孤对电子; 2)另一个成键原子的价电子层有空轨道
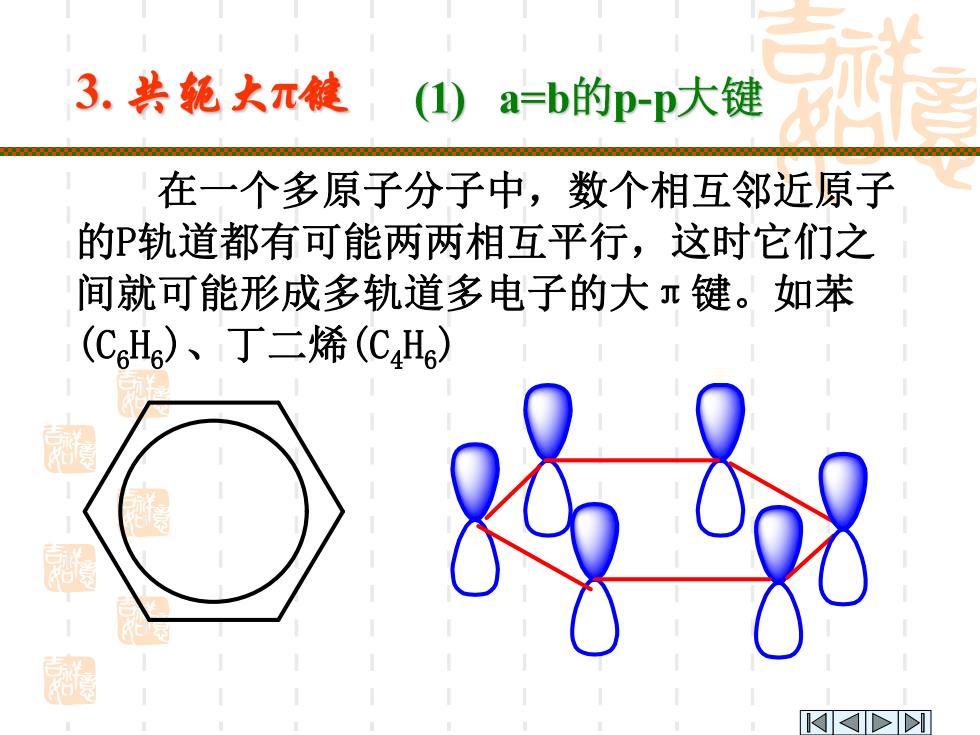
3.共轭大π能 (1) a=b的p-p大键 在一个多原子分子中,数个相互邻近原子 的P轨道都有可能两两相互平行,这时它们之 间就可能形成多轨道多电子的大兀键。如苯 (CH)、丁二烯(CH)
在一个多原子分子中,数个相互邻近原子 的P轨道都有可能两两相互平行,这时它们之 间就可能形成多轨道多电子的大π键。如苯 (C6H6)、丁二烯(C4H6)