
第三章 酸碱反应 §3.1酸碱质子理论 ק3.2 水溶液的质子转移年衡及 有关计算 §3.3缓冲溶液 返回
第三章 酸碱反应 § 3.3 缓冲溶液 § 3.2 水溶液的质子转移平衡及 有关计算 § 3.1 酸碱质子理论
§3.1酸碱质子理论 历史回顾 3.1.1 酸碱的定义 3.1.2 酸碱反应的实质 3.1.3 酸碱反应的类型 3.1.4酸碱的相对强弱 回
§ 3.1 酸碱质子理论 3.1.2 酸碱反应的实质 3.1.1 酸碱的定义 历史回顾 3.1.3 酸碱反应的类型 3.1.4 酸碱的相对强弱

3.1.1 酸碱的定义 酸:凡是能释放出质子(H+)的任何 分子或离子。 (质子的给予体) 碱:凡是能与质子(H+)结合的分子 无机化学电子教菜 或离子。 (质子的接受体)
酸:凡是能释放出质子(H+)的任何 分子或离子。 (质子的给予体) 碱:凡是能与质子(H+)结合的分子 或离子。 (质子的接受体) 3.1.1 酸碱的定义
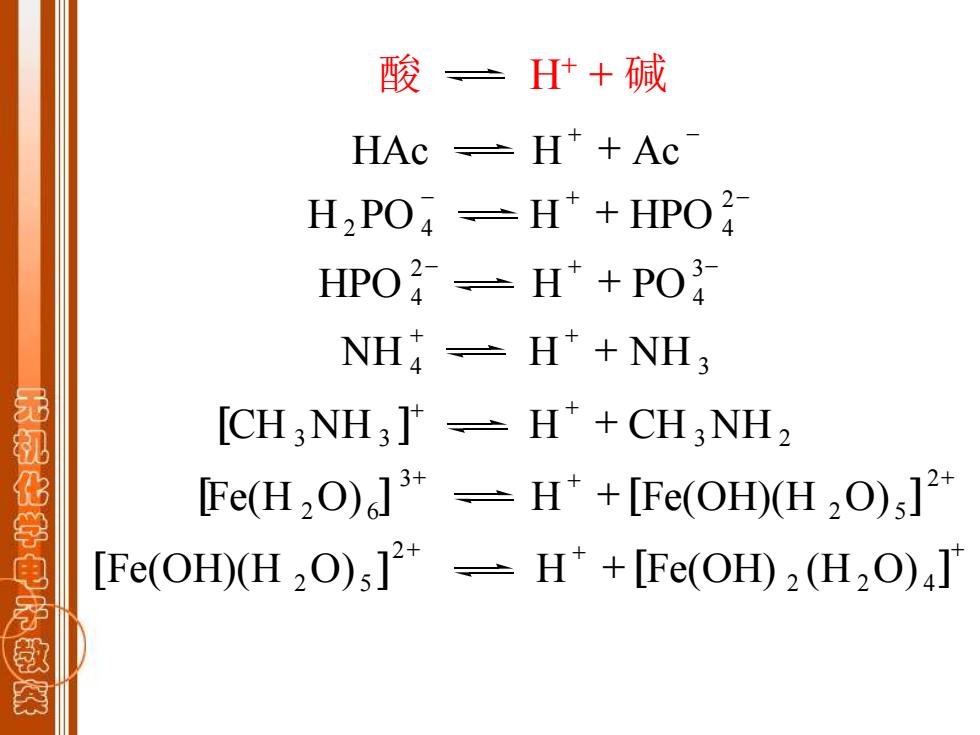
酸三 H+碱 HAc =H*+Ac H2PO =H*+HPO2 HPO子=H+PO NH-H*+NH3 无礼化学电子 [CH:NH3]*-H*+CH:NH2 IFe(H2O)]3-H*+[Fe(OH)(H2O);]2* [Fe(OH)(H2O)]2-H*+[Fe(OH)2(H2O)]
酸 H+ + 碱 + - HAc H + Ac - + - + 2 H2PO 4 H HPO 4 - + - + 3 4 2 HPO 4 H PO + + + NH 4 H NH 3 [ ] + + + CH 3NH 3 H CH 3NH 2 + + + + 2 2 5 3 [Fe(H 2O) 6 ] H [Fe(OH)(H O) ] + + + + 2 2 4 2 [Fe(OH)(H 2O) 5 ] H [Fe(OH) (H O) ]

酸 H++ 碱 例:HAc的共轭碱是Ac, Ac一的共轭酸是HAc, HAc和Ac为一对共轭酸碱。 两性物质: 无机化学电子教 既能给出质子,又能接受质子的物质。 如:HSO4,[Fe(OH)H,O), HC0,H,O,HS等
例:HAc的共轭碱是Ac- , Ac-的共轭酸是HAc, HAc和Ac-为一对共轭酸碱。 两性物质: 既能给出质子,又能接受质子的物质。 [ ] 等。 如: - - - + HCO ,H O,HS HSO , Fe(OH)(H O) , 3 2 2 4 2 5 酸 H+ + 碱