
4.1原电池 兴兴兴兴名兴 E=o°(Mn04/Mn2+)-0°(C02/H2C204) =1.512V-(-0.595V) =2.107V lg K nEo 10×2.107V =356 0.0592V 0.0592V K9=10356 2025/2/15 上页 下页 26
2025/2/15 26 4.1 原电池 356 2 2 2 4 2 4 10 356 0.0592V 10 2.107V 0.0592V lg 2.107V 1.512V ( 0.595V) (MnO / Mn ) (CO / H C O ) = = = = = = − − = − − + K nE K E

4.2电极电势 各晷晷光 0 4.2电极电势 4.2.1电极电势的产生 4.2.2电极电势的确定 4.23电极电势的能斯特方程式 2025/2/15 上页 下页 27
2025/2/15 27 4.2 电极电势 4.2 电极电势 4.2.1 电极电势的产生 4.2.2 电极电势的确定 4.2.3 电极电势的能斯特方程式

4.2电极电势 区名运名名军兴光 4.2.1电极电势的产生 电流的产生原因: 两电极存在电势差。 电动势E=Φ((+)-Φ(-) 电极电势的产生:双电层理论 20252/15 页 下页 28
2025/2/15 28 4.2 电极电势 4.2.1电极电势的产生 电流的产生原因: 两电极存在电势差。 电动势 E=φ(+)- φ(-) 电极电势的产生:双电层理论

4.2电极电势 各晷区晷兴 口金属的溶解与沉积平衡 Ms)午M++ne 当金属插入它的盐溶液中时,会 同时出现两个相反的趋向。 (I)金属表面上的M+受极性很大的水 分子吸引,离开金属而溶解于溶液中 (2)溶液中的M+可沉积到金属表面上 0 金属越活泼,M溶解的趋向越大; 0 溶液浓度越大,M+沉积的趋向越大 20252/15 下页 29
2025/2/15 29 4.2 电极电势 金属的溶解与沉积平衡 M(s) Mn+ + ne- 当金属插入它的盐溶液中时,会 同时出现两个相反的趋向。 (1)金属表面上的Mn+受极性很大的水 分子吸引,离开金属而溶解于溶液中 (2)溶液中的Mn+可沉积到金属表面上 金属越活泼, M溶解的趋向越大; 溶液浓度越大, Mn+沉积的趋向越大
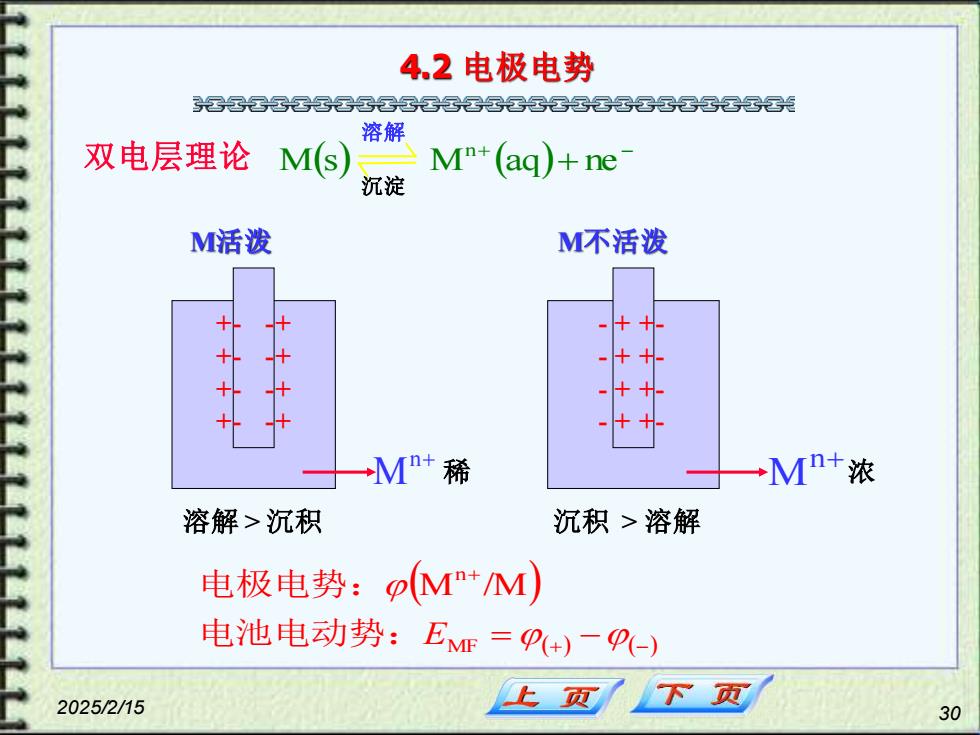
4.2电极电势 起兴兴名名晷名名兴国晷云汽 溶解 双电层理论 M(s) M+(aq)+ne 沉淀 M活泼 M不活泼 + 十十 十 M+稀 →Mn+浓 溶解>沉积 沉积>溶解 电极电势:pM+M) 电池电动势:EMm=+)一P-) 20252/15 上页 下页 30
2025/2/15 30 4.2 电极电势 ( ) ( ) + − M s M aq + ne n M活泼 M不活泼 n+ M 稀 M n+ 溶解 > 沉积 沉积 > 溶解 ( ) (+) (−) + = − MF n M /M 电池电动势:E 电极电势: - - - - + + + + + + + + - - - - - - - - + + + + + + + + - - - - - - - - 溶解 沉淀 浓 双电层理论