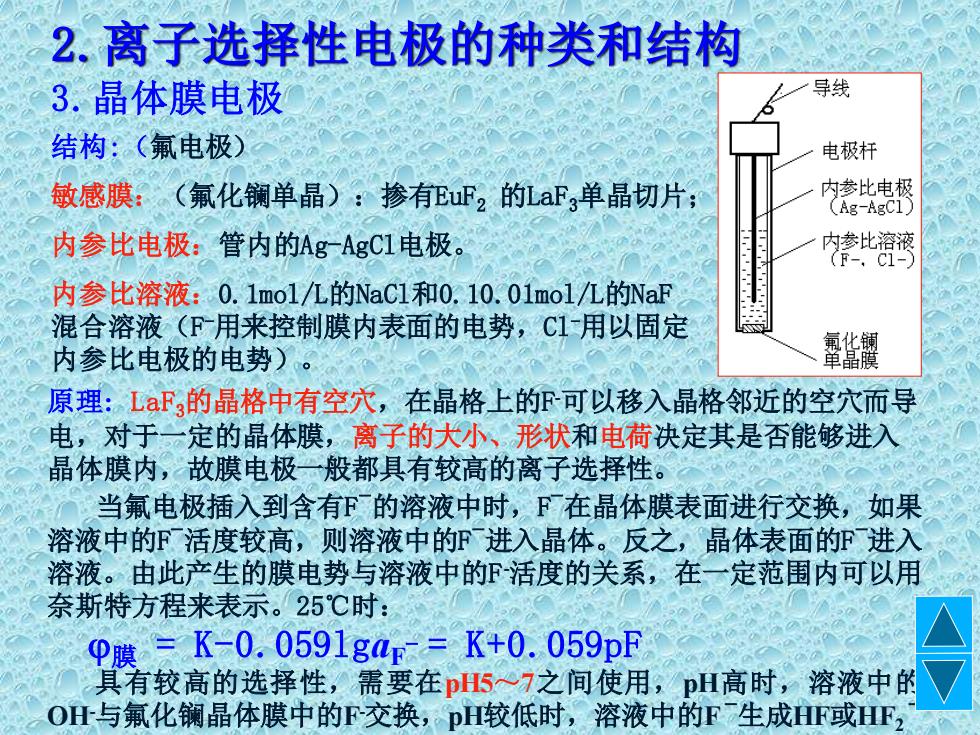
2.离子选择性电极的种类和结构 3.晶体膜电极 导线 结构:(氟电极) 电极杆 敏感膜:(氟化镧单晶):掺有EuF2的LaF3单晶切片; 内参此电极 (Ag-AgC1) 内参比电极:管内的Ag-AgC1电极。 管比湾湾 内参比溶液:0.1mol/九的NaC1和0,10.01mol/九的NaF 混合溶液(F用来控制膜内表面的电势,C1用以固定 内参比电极的电势)。 霏修额 原理:LDaF,的晶格中有空穴,在晶格上的F可以移入晶格邻近的空穴而导 电,对于一定的晶体膜,离子的大小、形状和电荷决定其是否能够进入 晶体膜内,故膜电极二般都具有较高的离子选择性。 当氟电极插入到含有F的溶液中时,F在晶体膜表面进行交换,如果 溶液中的F活度较高,则溶液中的F进入晶体。反之,晶体表面的F进入 溶液。由此产生的膜电势与溶液中的℉活度的关系,在一定范围内可以用 奈斯特方程来表示。25℃时: φ膜=K-0.0591gap=K+0.059pF 具有较高的选择性,需要在pH57之间使用,pH高时,溶液中的 O什与氟化镧晶体膜中的F交换,pH较低时,溶液中的F生成F或HF
2.离子选择性电极的种类和结构 3.晶体膜电极 结构:(氟电极) 敏感膜:(氟化镧单晶):掺有EuF2 的LaF3单晶切片; 内参比电极:管内的Ag-AgCl电极。 内参比溶液:0.1mol/L的NaCl和0.10.01mol/L的NaF 混合溶液(F -用来控制膜内表面的电势,Cl-用以固定 内参比电极的电势)。 原理: LaF3的晶格中有空穴,在晶格上的F -可以移入晶格邻近的空穴而导 电,对于一定的晶体膜,离子的大小、形状和电荷决定其是否能够进入 晶体膜内,故膜电极一般都具有较高的离子选择性。 当氟电极插入到含有F -的溶液中时,F -在晶体膜表面进行交换,如果 溶液中的F -活度较高,则溶液中的F -进入晶体。反之,晶体表面的F -进入 溶液。由此产生的膜电势与溶液中的F -活度的关系,在一定范围内可以用 奈斯特方程来表示。25℃时: 膜 = K-0.059lgaF - = K+0.059pF 具有较高的选择性,需要在pH5~7之间使用,pH高时,溶液中的 OH-与氟化镧晶体膜中的F-交换,pH较低时,溶液中的F -生成HF或HF2 -
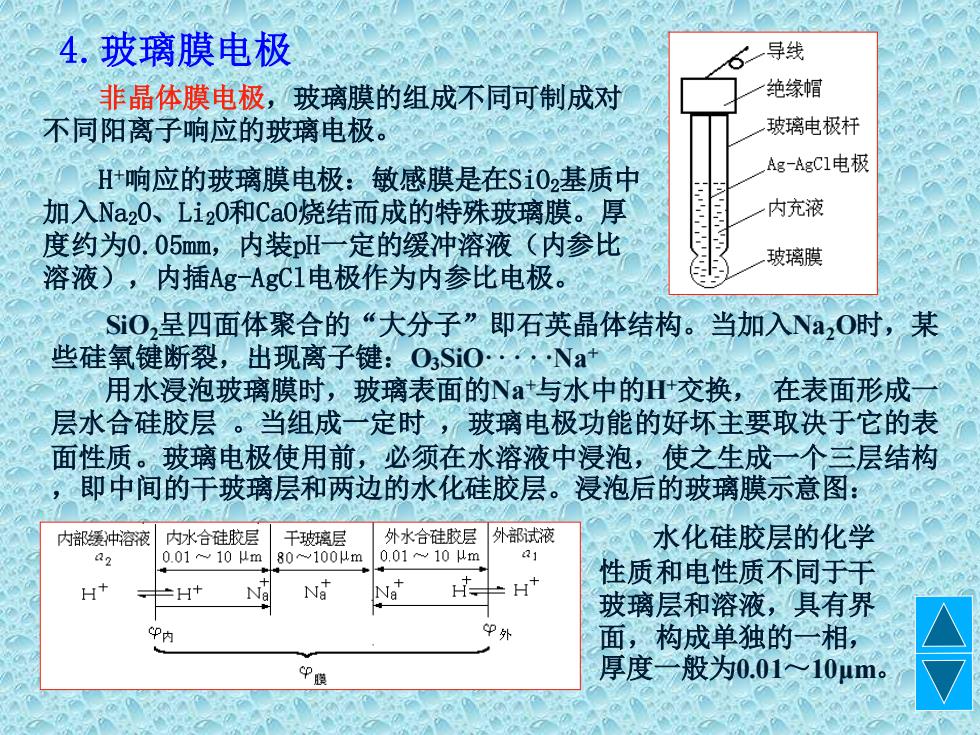
4.玻璃膜电极 导线 非晶体膜电极,玻璃膜的组成不同可制成对 绝缘帽 不同阳离子响应的玻璃电极。 玻璃电极杆 H+响应的玻璃膜电极:敏感膜是在$i02基质中 Ag-AgC1电极 加入Na20、Li20和Ca0烧结而成的特殊玻璃膜。厚 内充液 度约为0,05mm,内装pH一定的缓冲溶液(内参比 玻璃膜 溶液),内插Ag-AgC1电极作为内参比电极。 Si0,呈四面体聚合的“大分子”即石英晶体结构。当加入Na,0时,某 些硅氧键断裂,出现离子键:O3SiO·,·Na 用水浸泡玻璃膜时,玻璃表面的Nat与水中的H交换,在表面形成 层水合硅胶层。当组成一定时,玻璃电极功能的好坏主要取决于它的表 面性质。玻璃电极使用前,必须在水溶液中浸泡,使之生成一个三层结构 ,即中间的于玻璃层和两边的水化硅胶层。浸泡后的玻璃膜示意图: 内部缓冲溶液 内水合硅胶层 干玻璃层 外水合硅胶层 外部试液 水化硅胶层的化学 2 0.0110μm 80~100um 00110从m H 性质和电性质不同于干 H+ H Na Na 玻璃层和溶液,具有界 P内 P外 面,构成单独的一相, 厚度一般为0.01~≈10μm
4.玻璃膜电极 非晶体膜电极,玻璃膜的组成不同可制成对 不同阳离子响应的玻璃电极。 H +响应的玻璃膜电极:敏感膜是在SiO2基质中 加入Na2O、Li2O和CaO烧结而成的特殊玻璃膜。厚 度约为0.05mm,内装pH一定的缓冲溶液(内参比 溶液),内插Ag-AgCl电极作为内参比电极。 SiO2呈四面体聚合的“大分子”即石英晶体结构。当加入Na2O时,某 些硅氧键断裂,出现离子键:O3SiO·····Na+ 用水浸泡玻璃膜时,玻璃表面的Na+与水中的H+交换, 在表面形成一 层水合硅胶层 。当组成一定时 ,玻璃电极功能的好坏主要取决于它的表 面性质。玻璃电极使用前,必须在水溶液中浸泡,使之生成一个三层结构 ,即中间的干玻璃层和两边的水化硅胶层。浸泡后的玻璃膜示意图: 水化硅胶层的化学 性质和电性质不同于干 玻璃层和溶液,具有界 面,构成单独的一相, 厚度一般为0.01~10μm

在水化层,玻璃上的Li计或Nat与H发生离子交换而产生相界电势。 水化层表面可视作阳离子交换剂。溶液中+经水化层扩散至干玻璃层, 干玻璃层的阳离子向外扩散以补偿溶出的离子,离子的相对移动产生扩散电 势。 两者之和构成膜电势,可以用奈斯特方程式来描述。将浸泡后的玻璃膜 电极放入待测溶液,则由于水合硅胶层表面与溶液中的活度不同,形成活 度差,由活度大的方向活度小的一方迁移,达到平衡: H溶液二H硅胶 p内=k+0.0591g(2/a2') p外=k+0.0591g(1/a) 41、2分别表示外部试液和电极内参比溶液的H活度; 1'、2分别表示玻璃膜外、内水合硅胶层表面的活度 五、k2则是由玻璃膜外、内表面性质决定的常数。 由于玻璃膜内、外表面的性质基本相同,则1k2,1' 0膜=0外-/9内=0.0591g(a1/2) 由于内参比溶液中的活度(2)是固定的,则: p膜=K+0.0591g01=K-0,059pHt液
在水化层,玻璃上的Li+或Na+与H+发生离子交换而产生相界电势。 水化层表面可视作阳离子交换剂。溶液中H+经水化层扩散至干玻璃层, 干玻璃层的阳离子向外扩散以补偿溶出的离子,离子的相对移动产生扩散电 势。 两者之和构成膜电势,可以用奈斯特方程式来描述。将浸泡后的玻璃膜 电极放入待测溶液,则由于水合硅胶层表面与溶液中的H+活度不同,形成活 度差,H+由活度大的一方向活度小的一方迁移,达到平衡: H+ 溶液== H + 硅胶 内 = k1 + 0.059lg(a2/a2 ’) 外 = k2 + 0.059lg(a1/a1 ’) a1、a2分别表示外部试液和电极内参比溶液的H +活度; a1 ’ 、a2 ’分别表示玻璃膜外、内水合硅胶层表面的H +活度; k1、k2 则是由玻璃膜外、内表面性质决定的常数。 由于玻璃膜内、外表面的性质基本相同,则k1=k2,a1 ’ = a2 ’ 膜 = 外 - 内 = 0.059lg(a1 /a2) 由于内参比溶液中的H +活度(a2)是固定的,则: 膜 = K´+0.059lga1 = K´- 0.059pH试液

讨论: L.玻璃膜电极之所以能够测量溶液的pH是因为玻璃膜电势与试样溶液中的 pH成线性关系。式中K是由玻璃膜电极本身性质决定的常数: 2.电极电势应是内参比电极电势和玻璃膜电势之和: P玻璃=PAeC/Ag+P膜 3.不对称电势:如果内参比溶液与试样溶液中的H活度相同,即0三02, 则理论上φ膜0,但实际上仰膜0(由于玻璃膜内、外表面含钠量、表面张 力以及机械和化学损伤的细微差异所引起的),将此时仍存在的电势称之 为不对称电势。当玻璃膜电极经过长时间浸泡后(24r),不对称电势可 以达到最小且恒定(1~30mV),可以将其合并到公式中的K'项中; 4,高选择性:膜电势的产生不是电子的得失。其它离子不能进入晶格产生 交换。当溶液中Na浓度比H浓度高105倍时,两者才产生相同的电势; 5.酸差:测定溶液酸度太大(H<1)时,电势值偏离线性关系,产生误差 6“碱差”或“钠差”pH正心12产生误差,主要是Na参与相界面上的交换所 致; 7,改变玻璃膜的组成,可制成对其它阳离子响应的玻璃膜电极, 8.优点:是不受溶液中氧化剂、还原剂、颜色及沉淀的影响,不易中毒: 9.缺点:是电极内阻很高,电阻随温度变化
讨论: 1. 玻璃膜电极之所以能够测量溶液的pH是因为玻璃膜电势与试样溶液中的 pH成线性关系。式中K´是由玻璃膜电极本身性质决定的常数; 2. 电极电势应是内参比电极电势和玻璃膜电势之和: 玻璃 = AgCl / Ag + 膜 3. 不对称电势:如果内参比溶液与试样溶液中的H+活度相同,即1= 2, 则理论上膜=0,但实际上膜≠0(由于玻璃膜内、外表面含钠量、表面张 力以及机械和化学损伤的细微差异所引起的),将此时仍存在的电势称之 为不对称电势。当玻璃膜电极经过长时间浸泡后(24hr),不对称电势可 以达到最小且恒定(1~30mV),可以将其合并到公式中的K´项中; 4. 高选择性:膜电势的产生不是电子的得失。其它离子不能进入晶格产生 交换。当溶液中Na+浓度比H+浓度高1015倍时,两者才产生相同的电势; 5. 酸差:测定溶液酸度太大(pH<1)时, 电势值偏离线性关系,产生误差 6. “碱差”或“钠差”pH>12产生误差,主要是Na+参与相界面上的交换所 致; 7. 改变玻璃膜的组成,可制成对其它阳离子响应的玻璃膜电极; 8. 优点:是不受溶液中氧化剂、还原剂、颜色及沉淀的影响,不易中毒; 9. 缺点:是电极内阻很高,电阻随温度变化