
○A 18.某烃CHHA)在低温时与氯作用生成CH6QB卧,在高温时侧生成CHsCKC)。使(C)与乙基碘化镁反应得 C出D,后者与NBS作用生成CB。使E与氧化钾的乙醇溶液共热,主要生成CsD,后者又可与 顺丁烯二酸版应得G.写出A至G的结构及各步的反应式。 19.()HC-C进行烯丙基游离基澳代。反应产物是否有标记的HC=CHC4B?解释其原因 (2)下列化合物与HB进行亲电加成反应,请指出它们的相附活性: (a)HC-CHCH:CH (b)CHCH-CHCH (c)H2C-CHCH-=CH (d)CHCH-CHCH=CH: (e)H:C=QCHs}QCH)=CH (3)如果你想测定一个直立键B和一个平伏健B在S2取代反应中的相对速度,你能否用以下化合物 作对比: (1)顺和反1甲基4-澳环己烷 (2)顺和反1-叔丁基4-澳环己烷 (4)画出下列各二元取代环己烷最稳定的构象: (1)顺1氧2溴环己烷(2)反1氯4碘环已烷(3)顺1,3二羟基环己烷(4)顺1甲基4-叔 丁基环己烷(5)反1,3二羟基环己烷 20.以下列化合物为原料合成指定的化合物 (1) CH3 CHCOCH (2) CH;CH=C H2DH C=CH- CHCHCH CHCHCHCH (3) FCH2COCH3.B rCH2CH2COCH3- FCH2C(CH3)-C HCH2COCH3 (4) C →◇门-cH0 21.完成下列版应。 (1)CHSCHCH2CH (A)CHCH-CH,C(B) OH (2) H,c-○-cH0+cH,cH0oH +(A)=H0、(B) 3)(CH3)CCHO+HCHON (A)(B) ④ CHC8CH+,→W OH CHMg →(C) CN 6 N,D)20i0→(E
6 18.某烃 C3H6(A)在低温时与氯作用生成 C3H6Cl2(B),在高温时则生成 C3H5Cl(C)。使(C)与乙基碘化镁反应得 C5H10(D),后者与 NBS 作用生成 C5H9Br(E)。使(E)与氢氧化钾的乙醇溶液共热,主要生成 C5H8(F),后者又可与 顺丁烯二酸酐反应得(G)。写出(A)至(G)的结构及各步的反应式。 19.(1)14CH3CH=CH2 进行烯丙基游离基溴代。反应产物是否有标记的 H2C=CHC14H2Br?解释其原因。 (2)下列化合物与HBr 进行亲电加成反应,请指出它们的相对活性: (a)H2C=CHCH2CH3 (b)CH3CH=CHCH3 (c)H2C=CHCH=CH2 (d)CH3CH=CHCH=CH2 (e)H2C=C(CH3)-C(CH3)=CH2 (3)如果你想测定一个直立键 Br 和一个平伏键 Br 在SN2取代反应中的相对速度,你能否用以下化合物 作对比: (1)顺和反-1-甲基-4-溴环己烷 (2)顺和反-1-叔丁基-4-溴环己烷 (4)画出下列各二元取代环己烷最稳定的构象: (1)顺-1-氯-2-溴环己烷 (2)反-1-氯-4-碘环己烷 (3)顺-1,3-二羟基环己烷 (4)顺-1-甲基-4-叔 丁基环己烷 (5)反-1,3-二羟基环己烷 20.以下列化合物为原料合成指定的化合物 (1) (2) (3) (4) 21.完成下列反应。 (1) (2) (3) (4) (5) (5) CH3 H CH3 H (4) CH3COCH3 CH3CH CH3 CH3 CH3 OH C C H3C H=C H2,H C C H C H3C H2C H3C C H2C H2C H2C H3 O F C H 2 C O C H 3 , B rC H 2 C H 2 C O C H 3 F C H 2 C (C H 3 )=C H C H 2 C O C H 3 C HO (A) HCN CH3CHCH2CH3 CH3CCH2CH3 (B) OH O C HO C H3C HO -OH H2O + (A) (B) _ H3C (C H 3 )3C C H O H C H O N a O H + (A)+(B) , CH3CH2CCH3 H2NNH NO2 NO2 (A) O + CH3OH O CN K2CO3 C2H5MgBr NH4Cl 20%HCl O OH (A) (B) (C) (D) (E) + CH3CCH3 ,HCl,,
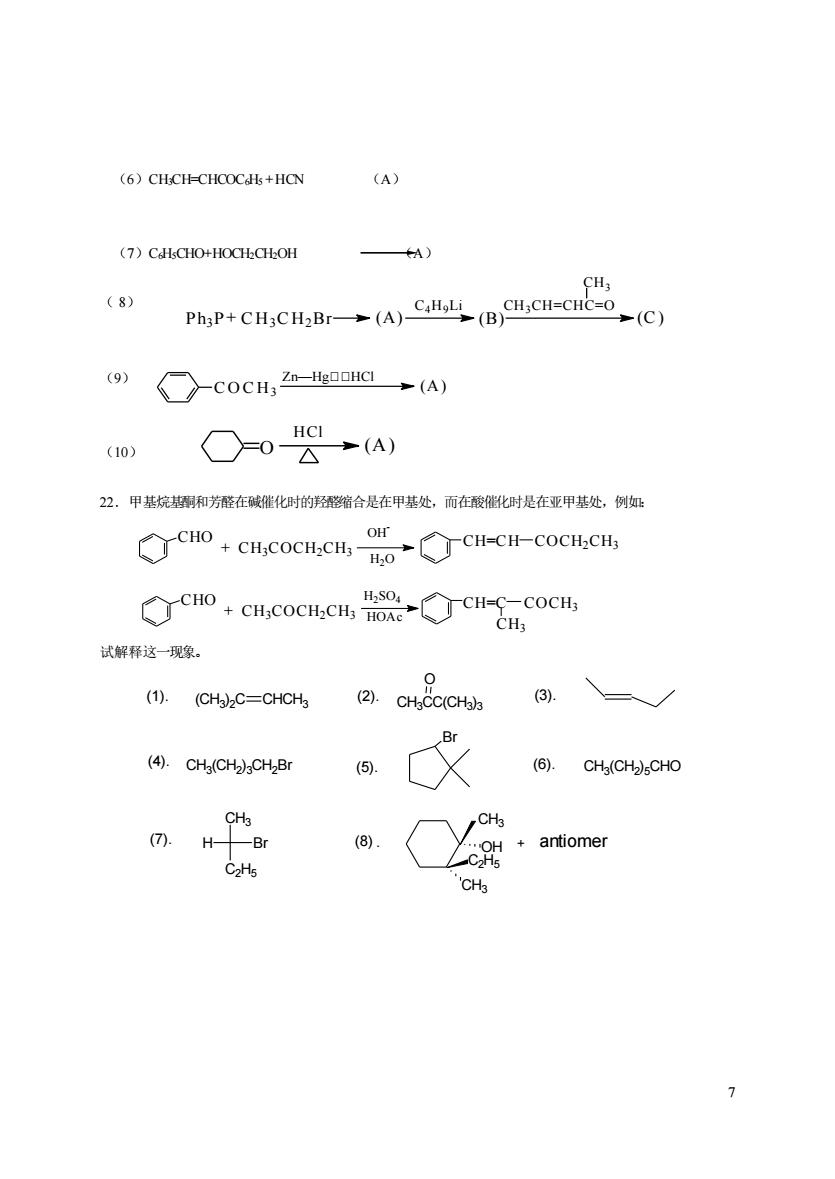
(6)CHCH-CHCOCHs+HCN (A) (7)CAHsCHO+HOCHCHOH ) CH (8) PhaP+()Cal (CCH-C- (C) (9) ○cocH,H (A) HCI (10) ○-0公→(A) 22。甲基烷和芳醛在碱催化时的醛缩合是在甲基处,而在酸化时是在亚甲基处,例如 cn cmcocm.cmc-coc OH ◇cHO+cH,cocH,cH,H0R。◇CH-CCOCH CH 试解释这一现象。 (1).(CHa)2C=CHCHg (2).CHgCC(CHa)3 Br (4).CHa(CH2)gCHzBr (6).CHg(CH2)CHO CHa CHa (⑦).HBr (8). CHa >
7 (6)CH3CH=CHCOC6H5 + HCN (A) (7)C6H5CHO+HOCH2CH2OH (A) ( 8) (9) (10) 22.甲基烷基酮和芳醛在碱催化时的羟醛缩合是在甲基处,而在酸催化时是在亚甲基处,例如: 试解释这一现象。 Ph3P CH3CH2Br C4H9Li CH3CH=CHC=O CH3 + (A) (B) (C) C O C H3 Zn—Hg,,HCl (A) O HCl (A) CHO CH3COCH2CH3 CH=CH CH=C COCH2CH3 COCH3 CH3 + OH - H2O H2SO4 HOAc + CH3COCH2CH3 CHO (CH3 )2C CHCH3 (1). (2). (3). CH3CC(CH3 )3 O (4). CH3 (CH2 )3CH2Br Br (5). (6). CH3 (CH2 )5CHO H Br CH3 C2H5 (7). (8) C2H5 OH CH3 . CH3 + antiomer

答案 OH (1).A CHg-CHCH=CH2 B 2.(①)醇分子中的务基度极化的,能在分了间形成氢健,这样的羟基越多,形成的氢健越多,分子间的作 用力越强,沸点越高。甲的形成导致形绒氢键的能力减溺,从而沸点降低。 (2)从产物看,反应()得到的是共轭体系的脂芳,而(B)没有这拌的共轭体系。另外,新制的 MO2特别适于丙醇或苄醇氧化为醛酮,这可能与其机理和产物的稳定性有关。 (3)分子(A)不能形成氢健,羟基处于平伏键最稳定。分子(B)由于含氧原子,羟基可以采用形 成氢键的构象使分子稳定,只有羟基在直立键上,羟基才可能与氧原子形成氢键。 H (A) (B) 0 3.高碘酸氧化邻二醇类化合物是可能是通过环状高碘酸酯进行的,二羟基必处于才能满足氧化反应的立 体化学要求。因此(2)和(3)不能被高碘酸氧化,(1)和(4)的氧化产物如下: 4 4该重排反应即是频阴醇重排,反应机理为:羟基质化:脱水生成碳正济无,料、关去质子得到稠。本题 的关键点在于要考虑脱去哪一个羟基能生成较稳定的碳正离子。 (1)的反应机理为: OH OH2 CeHs CoHs-H' (2)和(3)的胶应产刚别为: 5.(①)邻务基苯乙酮能形绒分子内氢键分子间作用力小100℃时在水蒸汽中有一定的分压,能用水蒸汽蒸 馏分离出来。 (2)邻羟基苯乙能形成分子内氢键而使体系稳定,是热力学稳定的,但生成它所需的活化能较大,是 平衡控制产物,高温时(165℃)邻羟基乙酮是主要产物: 生成对羟基苯乙聊时两个取代基没有空间位阳,所需活化能较低,故容易形城,它是速度控制产物,在低温时 (25℃)以生成对位异构体为主。 OH
8 答 案 1. 2.(1)醇分子中的羟基是高度极化的,能在分子间形成氢键,这样的羟基越多,形成的氢键越多,分子间的作 用力越强,沸点越高。甲醚的形成导致形成氢键的能力减弱,从而沸点降低。 (2)从产物看,反应(A)得到的是共轭体系的脂芳酮,而(B)没有这样的共轭体系。另外,新制的 MnO2特别适于烯丙醇或苄醇氧化为醛酮,这可能与其机理和产物的稳定性有关。 (3)分子(A)不能形成氢键,羟基处于平伏键最稳定。分子(B)由于含氧原子,羟基可以采用形 成氢键的构象使分子稳定,只有羟基在直立键上,羟基才可能与氧原子形成氢键。 3. 高碘酸氧化邻二醇类化合物是可能是通过环状高碘酸酯进行的,二羟基必须处于顺式才能满足氧化反应的立 体化学要求。因此(2)和(3)不能被高碘酸氧化,(1)和(4)的氧化产物如下: 4.该重排反应即是频哪醇重排,反应机理为:羟基质子化;脱水生成碳正离子;重排;失去质子得到酮。本题 的关键点在于要考虑脱去哪一个羟基能生成较稳定的碳正离子。 (1)的反应机理为: (2)和(3)的反应产物分别为: 5.(1)邻羟基苯乙酮能形成分子内氢键,分子间作用力小,100℃时在水蒸汽中有一定的分压,能用水蒸汽蒸 馏分离出来。 (2)邻羟基苯乙酮能形成分子内氢键而使体系稳定,是热力学稳定的,但生成它所需的活化能较大,是 平衡控制产物,高温时(165℃)邻羟基苯乙酮是主要产物; 生成对羟基苯乙酮时两个取代基没有空间位阻,所需活化能较低,故容易形成,它是速度控制产物,在低温时 (25℃)以生成对位异构体为主。 7 H3C CH3 OH CH3 CHCH CH2 (9). (10). CH3C(CH2 )4CCH3 O O (11). CH3 CH3 A B CH3 CH3 O O OH O O O H (A) (B) O O O O (1) (4) C(C6H5 )2 OH OH H + C(C6H5 )2 OH OH2 H2O C(C6H5 )2 OH C6H5 C6H5 OH H + C6H5 C6H5 O (C6H5 )2C CH3 COCH3 (2) (3) O (1). CH CH2 OH H + CHCH3 OH CH3 OH H + O CH3 (2). OH H + OH2 H2O H + (3). OH H + H2O OH2 H + (4). O H + OH OH OH OH H H +
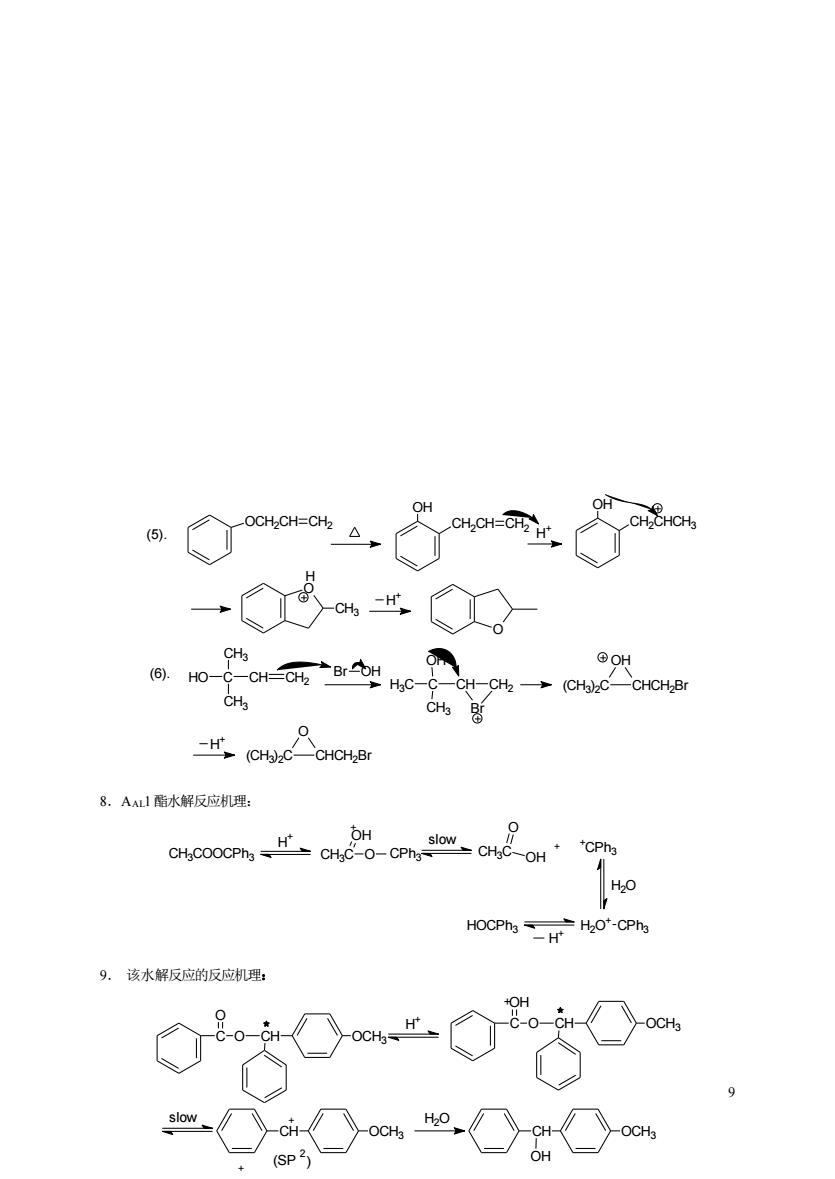
OH 6,.H0- CH-H→(C2 C-CHCH2B CH -H CH)CCHCHBr 8.AAl酯水解反应机理: OH HOCPhHO'-CPh 9.该水解反应的反应机理: (SP2)
9 8.AAL1酯水解反应机理: 9. 该水解反应的反应机理: (6). (CH3 )2C CHCH2Br O HO C CH CH3 CH3 CH2 O (5). OCH2CH CH2 OH CH2CH CH2 H + OH CH2CHCH3 O CH3 H H + Br OH H3C C CH OH CH3 CH2 Br (CH3 )2C CHCH2Br OH H + CH3COOCPh3 H + CH3C O O CPh3 H slow + CH3C O OH + +CPh3 H2O H2O + CPh3 H + HOCPh3 C O O CH OCH3 H + C O O CH OCH3 + H slow CO2H + CH OCH3 + H2O (SP ) 2 CH OCH3 OH (raceme)
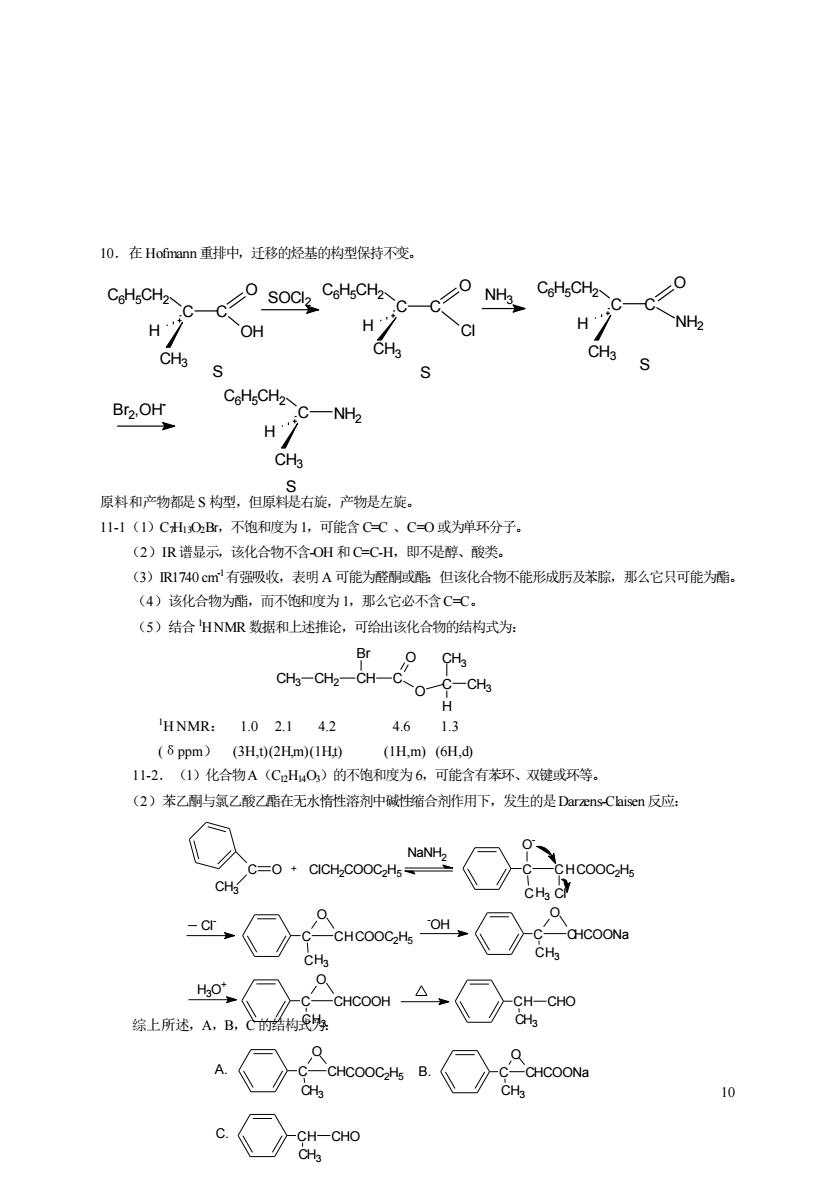
10.在Hofmann重排中,迁移的烃基的构型保持不变。 CoHgCH2 0 H H NH2 CHa CHa Br2.OH C6H5CH2 H CHa 原料和产物都是S构型,但原科呢右旋,产物是左旋。 11-1(1)CH0B,不饱和度为1,可能含CC、C0或为蝉环分子. (2)IR谱显示,该化合物不含OH和C-C-H,即不是醇、酸类。 (3)R1740cm有强吸收,表明A可能为醛酮或酯但该化合物不能形成庐及苯腺,那么它只可能为座。 (4)该化合物为酯,而不饱和度为1,那么它必不含C-C。 (5)结合HNMR数据和上述推论,可给出该化合物的结构式为: O-C-CH HNMR:1.02.142 4.613 (8 ppm)(3H,t)(2Hm)(IHt)(IH,m)(6H,d) 1-2.()化合物A(CHO)的不饱和度为6,可能含有茶环、双键或环等。 (2)苯乙酮与氯乙酸乙酯在无水惰性溶剂中碱缩合剂作用下,发生的是Darzens-Chisen反应: CHCOOCH 4. CHa 综上所述,A,B,的制为
10 10.在Hofmann 重排中,迁移的烃基的构型保持不变。 原料和产物都是 S 构型,但原料是右旋,产物是左旋。 11-1(1)C7H13O2Br,不饱和度为 1,可能含 C=C 、C=O 或为单环分子。 (2)IR谱显示,该化合物不含-OH 和C=C-H,即不是醇、酸类。 (3)IR1740 cm-1有强吸收,表明 A 可能为醛酮或酯;但该化合物不能形成肟及苯腙,那么它只可能为酯。 (4)该化合物为酯,而不饱和度为 1,那么它必不含C=C。 (5)结合 1H NMR 数据和上述推论,可给出该化合物的结构式为: 1H NMR: 1.0 2.1 4.2 4.6 1.3 (δppm) (3H,t) (2H,m) (1H,t) (1H,m) (6H,d) 11-2.(1)化合物A(C12H14O3)的不饱和度为 6,可能含有苯环、双键或环等。 (2)苯乙酮与氯乙酸乙酯在无水惰性溶剂中碱性缩合剂作用下,发生的是Darzens-Claisen 反应: 综上所述,A,B,C的结构式为: H C C6H5CH2 CH3 C O OH SOCl2 C O CH3 H C C6H5CH2 Cl NH3 C O CH3 H C C6H5CH2 NH2 CH3 H C C6H5CH2 Br2 ,OH - NH2 S S S S CH3 CH2 CH C Br O O C CH3 H CH3 C CH3 O + ClCH2COOC2H5 NaNH2 Cl - H3 C CHCOOC2H5 O - C Cl H3 C CHCOOC2H5 C O H3O + COOH H3 C CH C O H3 C CH C O COONa -OH CH CHO CH3 C C C O HCOOC2H5 H3 C C COONa C O H H3 A. B. C. CH CHO CH3