
(4)配位能 正常共价键: 成键两原子各提供一个电子配对形成共价键; 配位共价键: 由成键两原子中的一个原子单独提供电子对进 入另一个原子的空轨道共用电子对,简称配位键。 配位键必须具备两个条件: 1)一个成键原子的价电子层有孤对电子; 2)另一个成键原子的价电子层有空轨道
(4)配位键 正常共价键: 成键两原子各提供一个电子配对形成共价键; 配位共价键: 由成键两原子中的一个原子单独提供电子对进 入另一个原子的空轨道共用电子对,简称配位键。 配位键必须具备两个条件: 1)一个成键原子的价电子层有孤对电子; 2)另一个成键原子的价电子层有空轨道
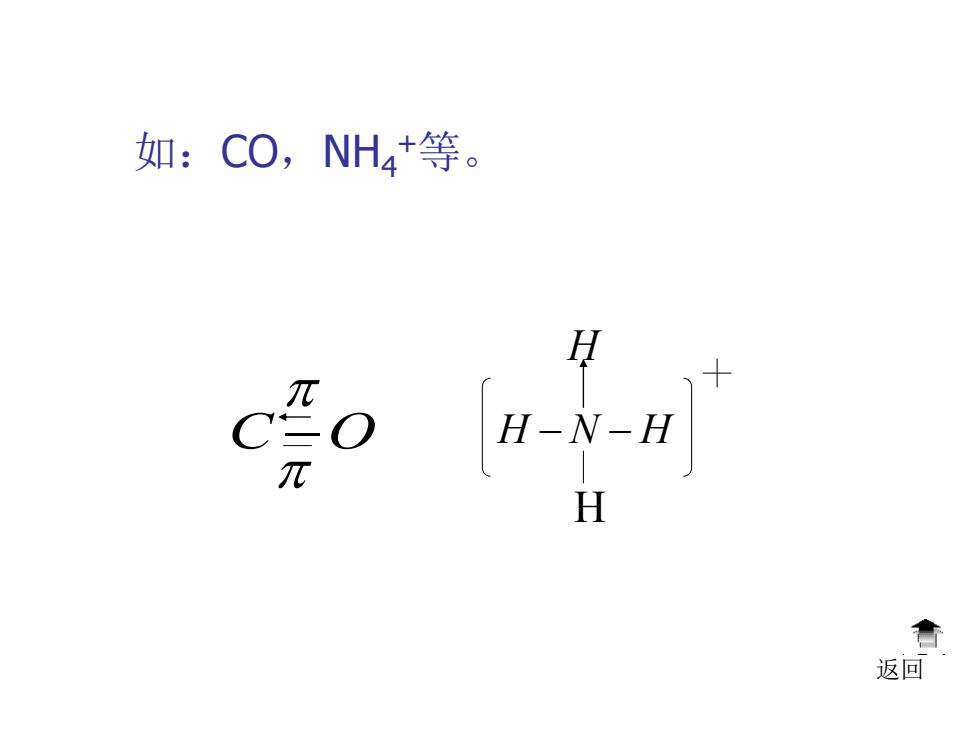
如:CO,NH4+等。 H-N-H H 音 返回
如:CO,NH4 +等。 H − N − H H H 返回 C −O

7.1.4健参数 1.键能 在标准态和指定温度下,将1mol气态分子某键 断裂时的焓变(平均值)。 解离能: 在标准态和指定温度下,将1ol气态分子某特 定键解离成气态原子时所需的能量。 AB(g)一→A(g)+B(g)过程的能量变化。 D(H-CI)=431kJ-mol-1 D(C1-C)=244kJ·mo1 双原子分子的键能就等于键的离解能
7.1.4 键参数 在标准态和指定温度下,将1mol气态分子某键 断裂时的焓变(平均值)。 1. 键能 解离能: 在标准态和指定温度下,将1mol气态分子某特 定键解离成气态原子时所需的能量。 AB(g)-→A(g)+B(g) 过程的能量变化。 双原子分子的键能就等于键的离解能。 D(H-Cl)=431kJ·mol-1 D(Cl-Cl)=244kJ· mol-1

在多原子分子中,如NH,有三个等同的N一H 键,键能应该是等同的,但每个键的离解能却不 同。 NH3(g)-→NH(g)+H(g) D (H2N-H)=435 kJ.mol-1 NH,g)-→NH(g)+H(g) D2(HN-H)=398 kJ.mol-1 NHg)-一→N(g+H(g)D3N-HD=339k.mol1 AH M (N-H)=(D+D2+D3)=391kJ.mol 键能越大,键越牢固,相应的分子也就越稳定
NH3 (g)-→NH2 (g)+ H(g) D1 (H2N-H)=435 kJ.mol-1 NH2 (g)-→NH(g)+ H(g) D2 (HN-H)=398 kJ.mol-1 NH(g)-→N(g)+ H(g) D3 (N-H)=339 kJ.mol-1 键能越大,键越牢固,相应的分子也就越稳定。 1 3 1 2 3 N H 1 391k J mol− H ( − ) = ( D + D + D ) = o m 在多原子分子中,如NH3有三个等同的N-H 键,键能应该是等同的,但每个键的离解能却不 同

7.1.4 能参数 2.键长(Lb) 分子中成键的二原子核间的平均距离称为键 长,单位一般为pm。 同一种键长随分子不同而异,键长与原子的 半径、轨道重叠程度有关。 (1)一般共价键的键长越短,键越牢固,分子越 稳定; (2)相同两原子形成的键键长,单键>双键>三键
分子中成键的二原子核间的平均距离称为键 长,单位一般为pm。 同一种键长随分子不同而异,键长与原子的 半径、轨道重叠程度有关。 2. 键长( Lb) (1)一般共价键的键长越短,键越牢固,分子越 稳定; (2)相同两原子形成的键键长,单键>双键>三键 ; 7.1.4 键参数