
氧化还原反应实质:得失电子,电子转移(氧化剂得到电子被还原,还原剂失去电子被氧化)氧化还原电对对称电对:氧化态和还原态的系数相同如: Fe3+ + e'= Fe2+Mn0+8H++5e=Mn2++4H,0氧化态与还原态系数不同不对称电对:如:I+2e-=2I-Cr,0,2- + 14H+ + 6e- = 2Cr3+ + 7H,0山东理工大6HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 氧化还原电对 对称电对:氧化态和还原态的系数相同 如: Fe3+ + e - = Fe2+ MnO4 - + 8H+ + 5e - = Mn2+ + 4H2O 不对称电对:氧化态与还原态系数不同 如: I2 + 2e - = 2I - Cr2O7 2- + 14H+ + 6e - = 2Cr3+ + 7H2O 氧化还原反应实质:得失电子, 电子转移(氧化 剂得到电子被还原,还原剂失去电子被氧化) 6

可逆/不可逆电对可逆电对:任一瞬间都能建立平衡,符合能斯特方程如:Fe3+/Fe2+,I,/I-等不可逆电对:不能在反应的任一瞬间建立起平衡,实际电势与理论电势相差较大。以能斯特公式计算所得的结果,仅作参考。等如: Cr,O,2-/Cr3+, MnO4/Mn2+能斯特方程:表示可逆氧化还原电对的电极电位0.059ao25°°℃gD=a山东理工大7SHANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 可逆电对:任一瞬间都能建立平衡,符合能斯特方程 如:Fe3+/Fe2+ , I2 /I- 等 不可逆电对:不能在反应的任一瞬间建立起平衡,实际电势 与理论电势相差较大。以能斯特公式计算所得 的结果,仅作参考。 如:Cr2O7 2- /Cr3+, MnO4 - /Mn2+ 等 可逆/不可逆电对 7 能斯特方程:表示可逆氧化还原电对的电极电位 O 0.059 lg (25 ) R a z a ℃

注意:(1) z:电对的电子转移数(2)β:标准电极电位,温度的函数,t=25℃时,ao=αr=1mol/L时的电极电位,β可查表(p407表15)。>高,其氧化型的氧化能力强,可氧化电位比它低的还原剂>β°低,其还原型的还原能力强,可还原电位比它高的氧化剂。>β随[H而改变,随a和a而变化。25℃,r=1.忽略离子间相互作用0.059O(25°℃D二1[R]山东翟工大8HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry (1) z:电对的电子转移数 (2) φ θ: 标 准 电 极 电 位 , 温 度 的 函 数 , t=25℃ 时 , aO =aR =1mol/L时的电极电位, φ θ可查表(p407 表15)。 φ θ 高,其氧化型的氧化能力强,可氧化电位比它低的还原剂。 φ θ 低,其还原型的还原能力强,可还原电位比它高的氧化剂。 25℃,r = 1, 忽略离子间相互作用 φ随[H+ ]而改变,随 aO和 aR而变化。 0.059 [O] lg (25 ) z R[ ] ℃ 注意: 8
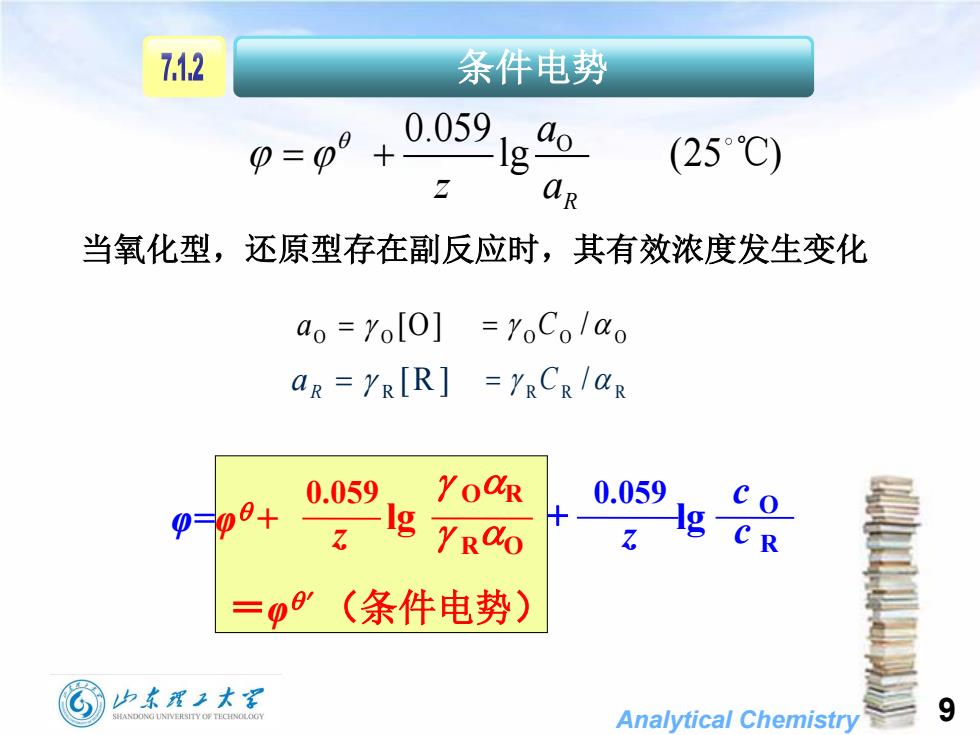
7.1.2条件电势0.059do(25℃)1gaRZ当氧化型,还原型存在副反应时,其有效浓度发生变化ao = [O]=roCo /αoaR=YR[R]=RCR/aRYOQR0.0590.0590=@0+Ig+IgRαCZ.7.R=β(条件电势)山东翟工大9SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 9 条件电势 O 0.059 lg (25 ) R a z a ℃ [O] O O a O O O C / [R ] R R a R R R C / 当氧化型,还原型存在副反应时,其有效浓度发生变化 =φ (条件电势) 0.059 lg 0.059 lg z c O z φ=φ + OR RO c R
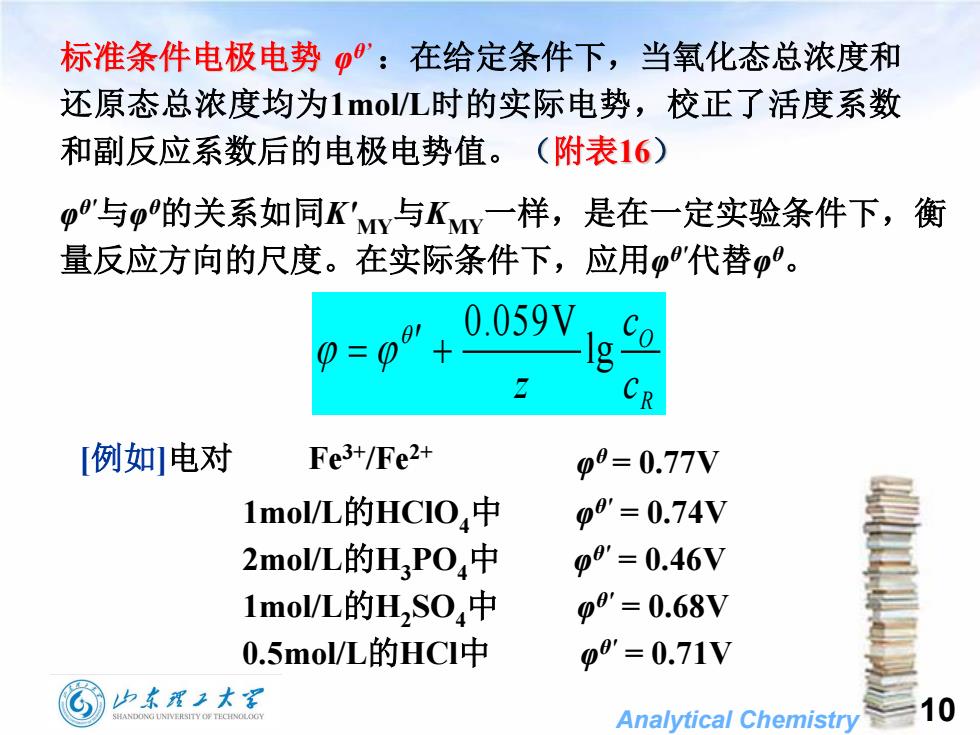
:在给定条件下,当氧化态总浓度和标准条件电极电势还原态总浓度均为1mol/L时的实际电势,校正了活度系数和副反应系数后的电极电势值。(附表16)β"与p的关系如同K'My与KMy一样,是在一定实验条件下,衡量反应方向的尺度。在实际条件下,应用β代替β。0.059VH10=10RFe3+/Fe2+[例如]电对β0= 0.77V1mol/L的HCIO4中β0= 0.74V2mol/L的H,PO,中β0'= 0.46V1mol/L的H,SO4中Φ0'= 0.68V0.5mol/L的HCI中β0'= 0.71V山东翟工大10HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 0.059V lg O R c z c 标准条件电极电势 φ θ’:在给定条件下,当氧化态总浓度和 还原态总浓度均为1mol/L时的实际电势,校正了活度系数 和副反应系数后的电极电势值。(附表16) φ θ'与φ θ的关系如同K'MY与KMY一样,是在一定实验条件下,衡 量反应方向的尺度。在实际条件下,应用φ θ'代替φ θ 。 [例如]电对 Fe3+/Fe2+ φ θ = 0.77V 1mol/L的HClO4中 φ θ' = 0.74V 2mol/L的H3PO4中 φ θ' = 0.46V 1mol/L的H2 SO4中 φ θ' = 0.68V 0.5mol/L的HCl中 φ θ' = 0.71V 10