
三、化学反应的Gibbs自由能变 如反应 C(S+0,(g)=====C02(g) 在标态下A,H9=-393.51kmo1, A S=2.96Jmol-1-K- 求300K和3000K的,G9 解:300K时△G日=-393.51-300×2.96×10-3 =-394.4kJm01
如反应 C(s)+O2 (g) ===== CO2 (g) =-394.4kJ·mol-1 在标态下 =-393.51 kJ·mol Δ rHm -1 , =2.96 J·mol Δ -1·K-1 rSm 求300K和3000K的Δ rGm 解:300K时 =-393.51-300× 2.96× 10-3 Δ rGm 三、化学反应的Gibbs自由能变

三、化学反应的Gibbs自由能变 3000K时A,G9-393.51-3000×2.96×103 =-402.4kJmo1-1 二者G仅相差8kJmo1,说明该反应 无论是在较高温度还是较低温度下,都是自发 的,A,He起主要作用。 b.当,H很小或H。一0 而Sm较大时,AS是决定反应自发性的主 要因素
=-402.4kJ·mol-1 3000K时 =-393.51-3000× 2.96× 10-3 Δ rGm 二者 仅相差8kJ·mol-1,说明该反应 无论是在较高温度还是较低温度下,都是自发 的, 起主要作用。 Δ rGm Δ rHm Δ rHm b . 当Δ rHm 很小或 0 而 较大时,Δ rSm 是决定反应自发性的主 要因素。 Δ rSm 三、化学反应的Gibbs自由能变

三、化学反应的Gibbs自由能变 当S>0时A,G<0反应可自发进行; 当S⊙<0时,△G>0反应非自发进行; c△Hm<0△Sm>0时,△Gm<0,反应总能 自发进行。 d△Hm>0△Sm<0时,△Gm>0,反应总 是非自发的
当Δ rSm >0时,Δ rGm <0反应可自发进行; 当Δ rSm <0时,Δ rGm >0反应非自发进行; c ΔrHm<0ΔrSm>0时 ,ΔrGm<0,反应总能 自发进行。 d ΔrHm>0ΔrSm<0时 ,ΔrGm>0,反应总 是非自发的。 三、化学反应的Gibbs自由能变
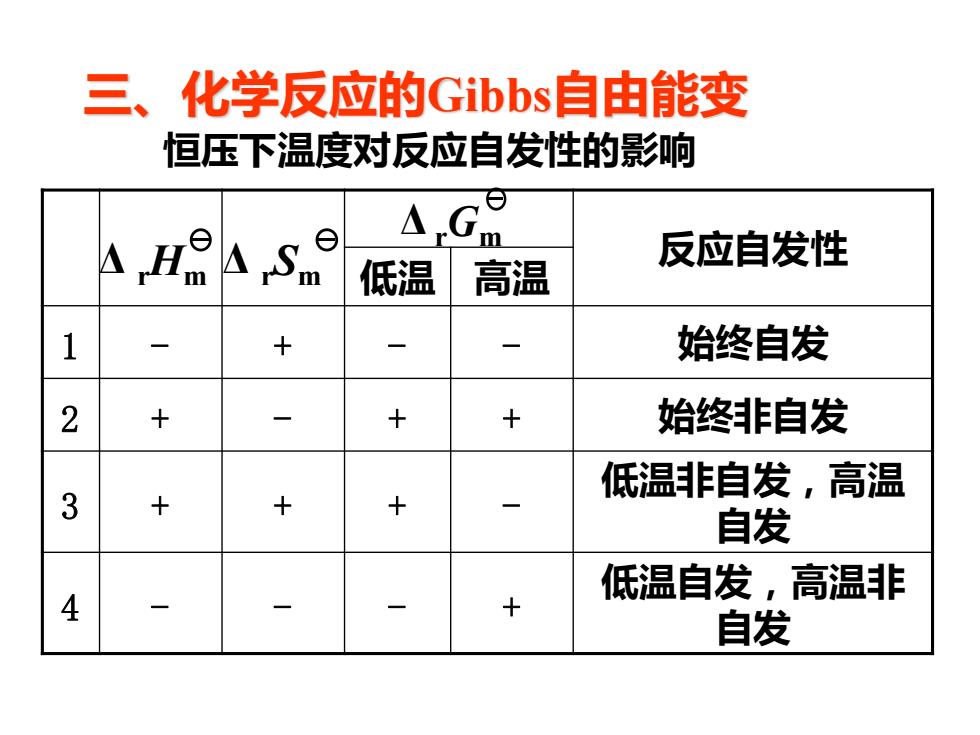
三、化学反应的Gibbs自由能变 恒压下温度对反应自发性的影响 △Gm 反应自发性 低温 高温 1 + 始终自发 2 + 十 + 始终非自发 低温非自发,高温 3 + + 自发 低温自发,高温非 4 自发
反应自发性 低温 高温 1 - + - - 始终自发 2 + - + + 始终非自发 3 + + + - 低温非自发,高温 自发 4 - - - + 低温自发,高温非 自发 恒压下温度对反应自发性的影响 Δ rGm Δ rHm Δ rSm 三、化学反应的Gibbs自由能变

2.1.3 热化学反寇方向的判断 标准摩尔Gibbs自由能变 的计算和反应方向的判断 热力学规定:“在标准状态和指定温度 下,最稳定单质的标准摩尔生成Gibbs自由能 为零”。 化合物的标准摩尔生成Gibbs自由能为: “在标准状态和指定温度下,由最稳定单质 生成1mol化合物时,反应的Gibbs自由能变称 为该物质的标准摩尔生成Gibbs自由能
热力学规定:“在标准状态和指定温度 下,最稳定单质的标准摩尔生成Gibbs自由能 为零” 。 化合物的标准摩尔生成Gibbs自由能为: “在标准状态和指定温度下,由最稳定单质 生成1mol化合物时,反应的Gibbs自由能变称 为该物质的标准摩尔生成Gibbs自由能” 。 2.1.3 热化学反应方向的判断 一、 标准摩尔Gibbs自由能变 的计算和反应方向的判断