
恒容过程dV=0 体系的始态体积等于终态的体积的过程。刚性密闭容 器中发生的是这种过程。 绝热过程Q=0 绝热体系中进行的过程。 g 循环过程 系统由某一状态出发经历一系列的变化又回到原状态 的过程,由于在循环过程中系统的初、末态是同一状态 因此状态函数的增量为零
F 恒容过程dV=0 体系的始态体积等于终态的体积的过程。刚性密闭容 器中发生的是这种过程。 F 绝热过程Q=0 绝热体系中进行的过程。 F 循环过程 系统由某一状态出发经历一系列的变化又回到原状态 的过程,由于在循环过程中系统的初、末态是同一状态, 因此状态函数的增量为零

热和功 功 体系和环境之间除了热以外的其他各种形式的能量传递均称为功。 系统得功为正值W>0,即环境对系统作功为正(压缩功);系统失功 为负值W<0,即系统对环境作功为负(膨胀功)。分为体积功和非体 积功。 意功的定义 δW=-F外d=-(F外/A)Ad=-Pamb dV 邕注意: 当外压为零时,W=0,即为真空中自由膨胀过程。 量纲:Pam3=Nm=J 途径函数:其微小过程用“6”表示,以示与全微分符号 “d”相区别。 积分:不能写作△W,只能写作W
B 功 体系和环境之间除了热以外的其他各种形式的能量传递均称为功。 系统得功为正值W>0,即环境对系统作功为正(压缩功);系统失功 为负值W<0,即系统对环境作功为负(膨胀功)。分为体积功和非体 积功。 B 功的定义 δW=-F外dl= -(F外/A) Adl= - Pamb dV B 注意: 当外压为零时,δW=0,即为真空中自由膨胀过程。 量纲:Pa·m3=N·m=J 途径函数:其微小过程用“δ”表示,以示与全微分符号 “d”相区别。 积分:不能写作ΔW,只能写作W。 热和功
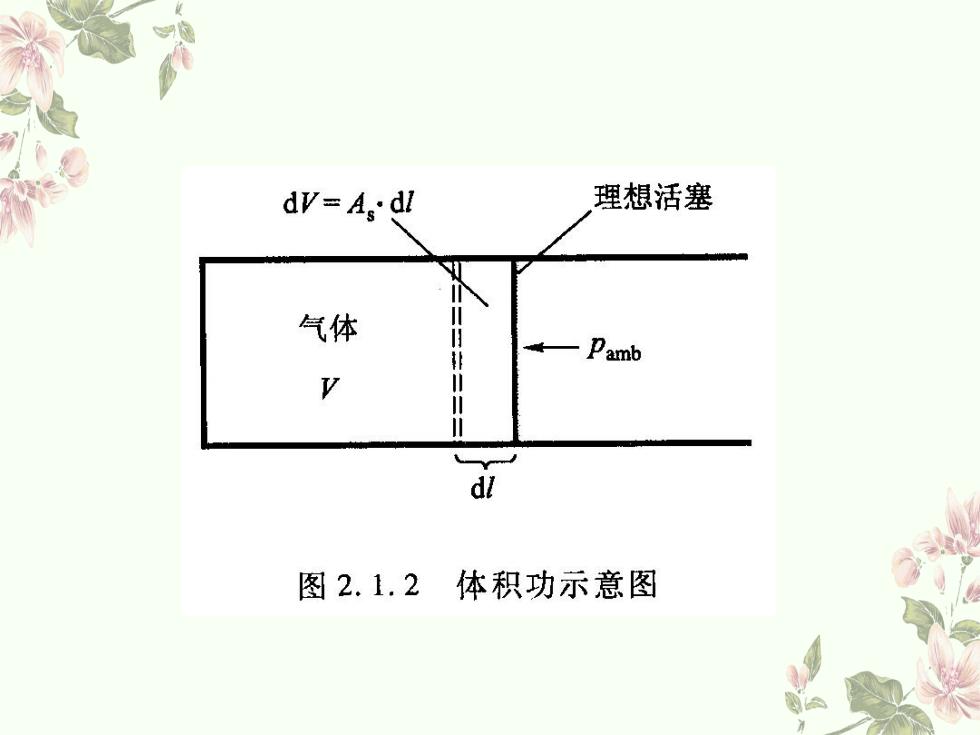
dv=A.dl 理想活塞 气体 。—Pamb V d 图2.1.2体积功示意图

热 系统和环境之间,因温度差而引起的能量传递,称为 热,也称热量,记作Q。体系吸热Q>0(Q为正),体系放 热Q<0(Q为负)。 三热不是状态函数,热是个过程量,没有过程就没有热 量。体系从A态变化到B态,采取的途径不同,过程中传 递的热量也不一定相同。非状态函数就没有全微分,微小 的热量不记作dQ而记作8Q。 三常见的热有三种显热、潜热、化学反应热
热 ¨ 系统和环境之间,因温度差而引起的能量传递,称为 热,也称热量,记作Q。体系吸热Q>0(Q为正),体系放 热Q<0(Q为负) 。 ¨ 热不是状态函数,热是个过程量,没有过程就没有热 量。体系从A态变化到B态,采取的途径不同,过程中传 递的热量也不一定相同。非状态函数就没有全微分,微小 的热量不记作dQ而记作δQ。 ¨ 常见的热有三种显热、潜热、化学反应热

热力学能内能 系统具有一个反映内部能量的函数,该函数值只取 决于始末状态,故是一个状态函数。这个函数就是热力学 能。也称为内能,U,单位J。 四 热力学能是系统内部能量的总和,其中包括分子运动 的动能、分子之间相互作用的势能、以及分子内部各种粒 子运动的动能及它们相互作用的势能等
热力学能内能 & 系统具有一个反映内部能量的函数,该函数值只取 决于始末状态,故是一个状态函数。这个函数就是热力学 能。也称为内能,U,单位J。 & 热力学能是系统内部能量的总和,其中包括分子运动 的动能、分子之间相互作用的势能、以及分子内部各种粒 子运动的动能及它们相互作用的势能等