氧化还原反应的实质Zn棒ECuSO4ZnSO
一、氧化还原反应的实质

*Cu2+ + 2e = CuΦ=0.158V*Zn -2e = Zn2+Φ=-0.7628V(1)电对的电位越高,其氧化态的氧化能力越强电对的电位越低,其还原形的还原能力越强(2)电对之间的电位差是氧化还原反应的推动力
❖Cu2+ + 2e = Cu Φ=0.158V ❖Zn -2e = Zn2+ Φ=-0.7628V (1)电对的电位越高,其氧化态的氧化能力越强; 电对的电位越低,其还原形的还原能力越强。 (2)电对之间的电位差是氧化还原反应的推动力

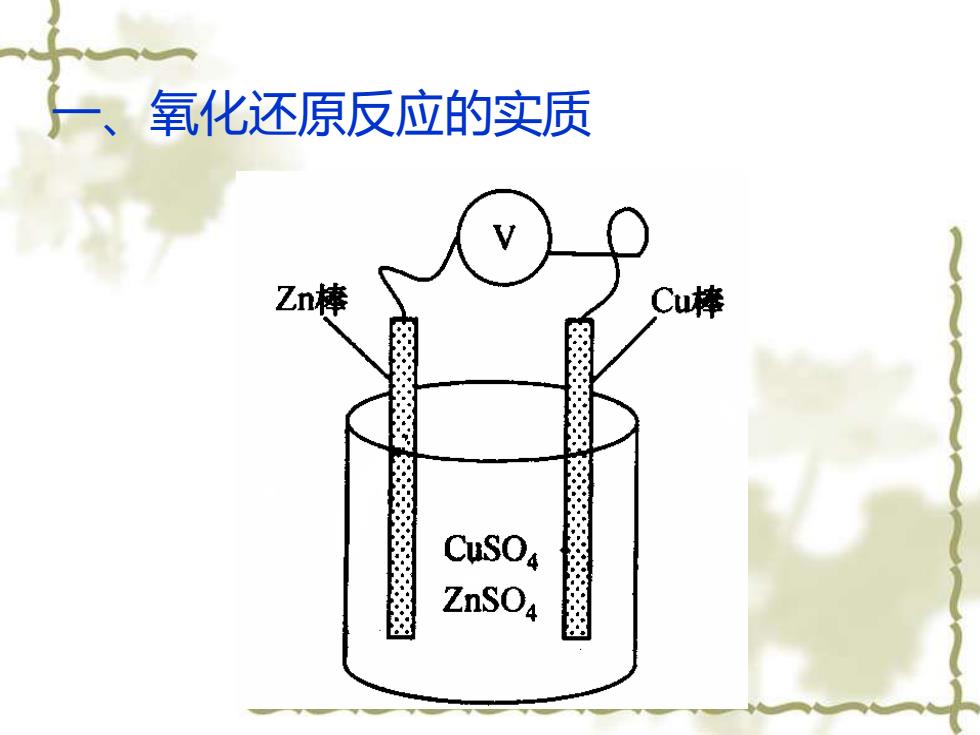
用导向将铜棒和锌棒连接起来(1)在导线中电子定向移动产生电流(2)在溶液中有离子的定向移动,也有电流流动;(3)在铜棒和锌棒表面,即电极表面发生氧化还原反应
用导向将铜棒和锌棒连接起来 (1)在导线中电子定向移动产生电流; (2)在溶液中有离子的定向移动,也有电流流动; (3)在铜棒和锌棒表面,即电极表面发生氧化还原 反应

电极电位Red,Ox, + neRed,Ox, + neOx, + Red2Ox, + Redj电对的电极电位衡量氧化或还原能力的强弱电对的电极电位越高,其氧化态的氧化能力越强(还原形的还原能力越弱)一一氧化剂电对的电极电位越低,其还原态的还原能力越强(氧化形的氧化能力越弱)一一还原剂
电极电位 ➢ 电对的电极电位衡量氧化或还原能力的强弱 ➢ 电对的电极电位越高,其氧化态的氧化能力越强 (还原形的还原能力越弱)——氧化剂 ➢ 电对的电极电位越低,其还原态的还原能力越强 (氧化形的氧化能力越弱)——还原剂 Ox1 + ne Red1 Red2 Ox2 + ne Ox1 + Red2 Ox2 + Red1

电极电位的NERNST表示式1.活度表示式2.303RTaoxpox/Red =ponFaRed0.059aox(25℃C)pox/Red =peIgnaRed2.浓度表示式: aox = Yox[Ox], aRed =YRea[Red]Yox[Ox]0.059= 0ox/Red = p° + YRea[Re d]n
电极电位的NERNST表示式 1. 活度表示式 2. 浓度表示式 d Ox Ox d a a n F RT Re / Re ln 2.303 = + lg (25 ) 0.059 0 Re / Re C a a n d Ox Ox d = + [ ] [Re ] aOx = Ox Ox ,aRed = Red d [Re ] [ ] lg 0.059 Re /Re d Ox n d O x O x d = +