
部 HH 0 H Ho H-C-C-H H-C-H H-C=C-H H-N-H H-C-N-H H-N-C-C-6-H HH H (ii) (iv) (vi) (vii) 习题根据八隅规则,在下列结构式上用黑点标明所有的孤对电子。 (i)HOCOCH o a 答0 (n) (ni) .y NN: 习题15 下列化合物中,哪些是离子化合物?哪些是极性化合物?哪些是非极性化合物? KBr.I.CH,CH,.CH,Br.CH.OH 答 KBr是离子化合物,CHBr、CH,(OH是极性化合物.l,CH,CH是非极性化合物 回题16结合教材表13中的数据回答下列问题: ()下列化合物中,编号所指三根CH键的键长是否相等?为什么? CH-CCH ()下列化合物中,编号所指碳碳键的键长是否相等?为什么? CH.PCHCH-CH-CCH ()卤甲烷中,碳氟键与碳碘键的键长为什么不同? (v)氯甲烷和氯乙烷中,碳氯键的键长是否相等?为什么? 答()箭头所指三根C一H键的键长不相等。因为碳原子的杂化轨道中s成分的含量越多,该碳原 子的电负性越大。电负性大的碳原子对电子的吸引强,相应的C一H键键长会短一些。因此这 三根碳氢键的键长顺序为:②>①>③。 ()箭头所指五根碳碳健的键长不相等。①是碳碳参键一根C一Cσ键和两根C。一C。健 ①是碳碳双键,一根C一C中σ键和一根C,一C,π键,②③⑤虽然均为碳碳单键.但碳原子成 键的杂化轨道不同,⑤为Cw一Ca键.②为C一(σ键.③为Cp一Cwσ键。由于键级不同 和形成。键的杂化轨道不同,所以它们的键长不相等。这五根碳碳键的键长顺序为:①<①<⑤ <)<③. ()由于氟原子的电负性大于碘原子的电负性,且氟原子的半径小于碘原子的半径,所以在肉甲 皖中.(一1鞋的建长大于(一F键的键长 (v)不相等。氯乙烷的C一C1键键长比氯甲烷的短。因为氯甲烷的碳原子形成一根C(1键和 三根C一H键,而氯乙烷中的碳原子形成一根CC键、两根CH键和一根C(H键由于 甲基的给电子效应,使得C(I键具有更大的极性,碳、氯两个原子靠得更近

可题7 在下列化合物中,有几个即杂化的碳原子?有几个p杂化的碳原子:有几个杂化的碳原子? 最多有几个碳原子共平面?最多有几个碳原子共直线?哪些原子肯定处在:两个互相垂直的平面中? CH2=C=CH-CH-CH:-C=C-CH; CHaCH3 答有5个s即杂化的碳原子,2个sp杂化的碳原子,3个sp杂化的碳原子。最多行8个碳原子共平 面。最多有4个碳原子共直线。联烯部分,】号碳原子所连的两个氢原子和3号碳原子所连的一 个碳原子和一个氢原子肯定处于两个互相垂直的平面上。 HC=C=CH-CH-CH2-c=C-CH 匀题18 )将下列各组化合物中有下划线的键按键解离能由大到小排列成序。 0 (i)CH CH2-H CH;CH2CH-H ○-Hc-H ()F -a4=1○-ct-ouCa-N:《○eN (i)CH-H CHCHa-F (CH):CH-CI CH=CHCH-OH CH,-1 CH:=CH-CN 答0○-H>H00-H,cH,9I H;C m○aw>r,○atom>○-aiN4,○-u 习题1-9 G-CC-C-CHC-OMC 按酸碱的质子论,下列化合物哪些为酸?哪些为碱?哪些既能为酸,又能为碱? H:S NH,SO H;O HCIO NH,HSO. F HCN 答H0,HCIO,HCN为酸:H,S,NH,H,N、HSO,既能为酸,又能为碱:S万F为碱 习题D按酸碱的电子论,在下列反应的化学方程式中,哪个反应物是酸?哪个反应物是碱” NH+H0→NH+HO (Hs+F→H,S mc8a·Am ·+AIc HaC (w)CH,0CgH+BH,→ 0→BH (wi)Cu0+sO2→Cus0 CoHs 答(i)H,O是酸,H,N是碱: (i)H是酸,HS是碱: (m)HC1是酸,○N是碱: (iv)AIC1,是酸,CH,C()CI是碱: (v)BH是酸,CH,OC,H是碱 (vi)SO2是酸,Cu()是碱。 可题1D略
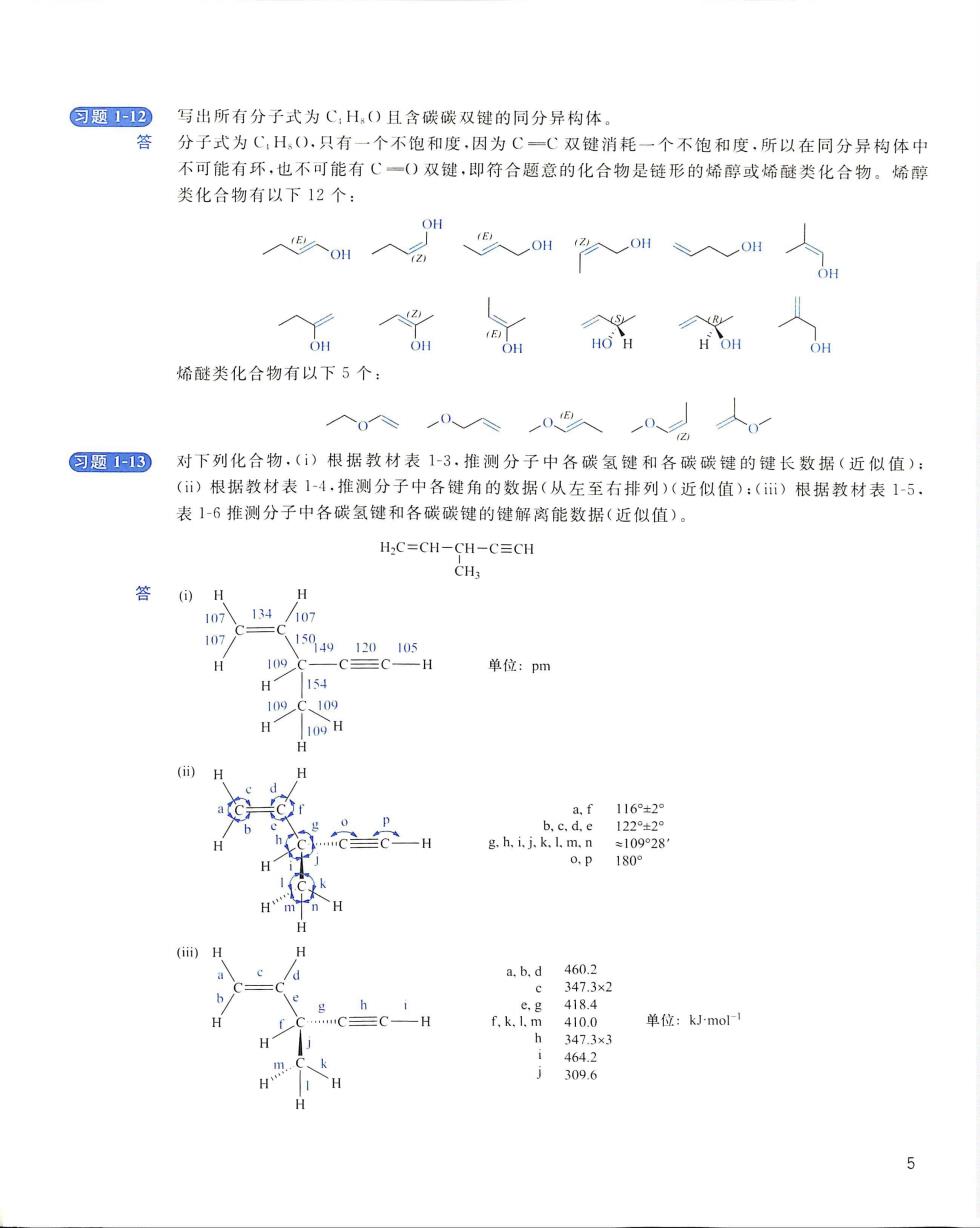
回题2写出所有分子式为C,H,()且含碳碳双键的同分异构体 分子式为C:H,().只有一个不饱和度,因为C一C双键消耗一个不饱和度,所以在同分异构体中 不可能有环,也不可能有C一()双键,即符合题意的化合物是链形的烯醇或烯醚类化合物。烯醇 类化合物有以下12个: 烯醚类化合物有以下5个: 匀题113 )对下列化合物.()根据教材表1-3,推测分子中各碳氢键和各碳碳键的键长数据(近似值): ()根据教材表1-4.推测分子中各键角的数据(从左至右排列)(近似值):()根据教材表1-5, 表1-6推测分子中各碳氢键和各碳碳键的键解离能数据(近似值) H:C=CH-CH-C=CH CHi 答 H 107入134/07 H 109 -C三C -H 单位:pm H H H b.e af H PRLAE H分H H a.b.d H 4100 单位:kJ-mol 3096 H 5

匀题9回答下列问题: ()在下列反应中,H,SO,是酸还是碱?为什么? HONO2 +2H2S04H:O*2HSO +NO: 0 (Gi)为什么CH,NHz的碱性比CH,CNH,强? ()下列常用溶剂中,哪些可以看做Lewis碱性溶剂?为什么? ) CH)CHOH CH.CH-OCH.CH CH,cCH,CH.SCI HCN(CII 新成烷环己烷甲醇 乙醚 丙酮 :甲基甲酰胺 (DMF) (iv)在下列反应中,哪个反应物是Lewis酸?哪个反应物是I.cwis碱 1+ ○+2B购→ 答()H:S0,是酸,因为它在反应中提供H。 (G①由于在CH,NH,中,CH,具有给电子诱导效应和给电子超共轭效应,而在CH,CN中.CH,C具 有吸电子诱导效应和吸电子共轭效应,因此CH,NH:中的氮原子比CH,N,中的氨原子提供孤对 电子的能力更强,也即CHNH:具有更强的碱性。 (曲)Lwis酸碱电子理论认为:凡是能给出电子对的分子,离子或原子团都是碱,所以在所提供 的溶剂中,甲醇、乙醚,丙酮、二甲亚砜、二甲基甲酰胺、吡啶均可看做碱性溶剂。 (iv)在上面的反应中,Br,是Lewis酸,苯是Lewis碱。 6

第2章 有机化合物的分美 表示方式命名 有机化合物数日繁多.掌握有机化合物的分类,系统命名及其表达方式是学习有机化合物的 第一步。 内容提要 21有机化合物的分类 有机化合物有两种主要的分类方法。按碳架分类,各类化合物的关系如下: C开链化合物(脂肪族化合物) 有机化合物 「脂环族化合物 碳环化合物 芳香族化合物 ,环状化合物 { 按官能团分类,有机化合物可分为:烷烃(母体·无官能团),烯烃、炔烃、卤代烃、醇、酚、硫醇 硫酚、醚、醛、酮、磺酸、羧酸酰卤,酸酐,酯,酰胺、胺,亚胺、硝基化合物,亚硝基化合物、晴等。 2.2 有机化合物的表示方式 分子中,原子的连接次序和键合性质叫构造。表达分子构造的化学式叫构造式。构造式有 L,©ws结构式蛛网式,结构简式和键线式四种表达方式。不仅表示分子中各原子的连接次序和 键合性质,还表示原子在空间排列的化学式称为立体结构式,有伞形式,锯架式,Newman投影式 和Fischer投影式。其中表达伞形式的规定是:处于纸面上的键用实线表示.用虚楔形线表示伸 向纸面里的键,用实楔形线表示伸向纸面外的键。 23有机化合物的同分异构体 在有机化学中,具有相同分子式而具有不同结构的现象称为同分异构现象。具有相同分子 式而结构不同的化合物互称为同分异构体,也称为结构异构体,同分异构体可以划分成各种类