
上式两边取负村数,并令: pEo lgk/n p E=-lgfe] 训得. PE pE+1/n lg [Ox]/[Red] 3-1) 这里pE是氧化还原平衡体系电子浓度的负对数,其定义与pH=-g[H门相似。pEO是氧化态和还原 态浓度相等时的pE,或是1gk。准确地讲,应用电子活度来代替上述的电子浓度。 从pE概念可知,pE越小,电子浓度越高,体系提供电子的倾向就越:反之,pE越大,电子浓度 越低,体系接受电子的倾向就越强。当pE增大时,体系氧化态相对浓度升高。实际上,pE的指示作用与 熟知的电极电位E的指示作用相同,它们之问可以相互换算。 因为E0=2.303RT/nF1gk pE=1/n lgk 所以E0=2.303RTDE0/F 将R=8.314]/Kmol.F=96500C代入上式,并今T=298K则得 pE0=16.92E0 3-2 E=2.303RT/F (1/n lgk +1/n lg[Ox]/[Red]) E=2.303RT/F (pE+1/n lg[Ox]/[Red]) 代入(3-1).得 E=2.303 RT/F pE 当T=298K时, pE=16.92E (3-3) 由于pE0不能实测,须用E0实验值,通过(3-2)式计算得到。有了pE0,如果知道氧化态和还原态 的浓度,用浓度代替活度,就可以求出非标准状态的pE值。 近年来,水化学中为何不用E而改用pE表示氧化还原电位?首先,pE有明确的物理意义,pE=g[e 表示相对电子浓度:其次,pE每政变1个单位,[Ox/Red]就变化10倍(n=1),便于对比。 ·pE-Igc图 一些氧化还隙反应的电极电位与氧化剂、还原剂的浓度以及氢离子浓度有关。另一些反应只与氧化剂 还原剂的浓度有关。pE与氧化剂、还原剂浓度之间的关系可用1gc-pE图表示。现以Fe3+-Fe2-HP0 系的ac-DE图为例加以说明。 当Fe3+-Fe2+-H20体系中溶解的总铁浓度为1×103mol几时,对于下列反应 Fe3+e==Fe2+,pE0=13.05 pE=13.05+lg[fe3+]/[fe2+] 当pE<<DEo时,[Fe3+]<<[Fe2+] [Fe2+]s cTFe =1x10-3mol/L,Ig[Fe2+]=-3(a) 得:lg[Fe3+]=pE-16.05b) 当pE>>pE0时,[Fe3+]>>[Fe2*】 [Fe]cTFe=1x10-3mol/L,Ig[Fe+]=-3(c) 即得:lg[Fe2+]=10.05-pE(@) 由(a),b),(c),(d)4式可作[Fe3+]-Fe2+]体系的lgc-pE图(图3-8)
上式两边取负对数,并令: pE0 = lgk /n p E = -lg[e] 则得: pE = pE0 + 1/n lg [Ox]/[Red] (3-1) 这里 pE 是氧化还原平衡体系电子浓度的负对数,其定义与 pH=-lg[H+]相似。pE0是氧化态和还原 态浓度相等时的 pE,或是 lgk/n。准确地讲,应用电子活度来代替上述的电子浓度。 从 pE 概念可知,pE 越小,电子浓度越高,体系提供电子的倾向就越强;反之,pE 越大,电子浓度 越低,体系接受电子的倾向就越强。当 pE 增大时,体系氧化态相对浓度升高。实际上,pE 的指示作用与 熟知的电极电位 E 的指示作用相同,它们之间可以相互换算。 因为 E 0 = 2.303 RT /nF lgk pE0 = 1/n lgk 所以 E 0=2.303RT pE0/F 将 R=8.314 J/K·mol,F=96500 C 代入上式,并令 T=298 K 则得: pE0=16.92E0 (3-2) 而 E = 2.303RT/F {1/n lgk +1/n lg[Ox]/[Red]} 即 E =2.303RT/F{pE0 +1/n lg[Ox]/[Red]} 代入(3-1),得: E = 2.303 RT/F pE 当 T=298 K 时, pE = 16.92E (3-3) 由于 pE0不能实测,须用 E 0实验值,通过(3-2)式计算得到。有了 pE0,如果知道氧化态和还原态 的浓度,用浓度代替活度,就可以求出非标准状态的 pE 值。 近年来,水化学中为何不用 E 而改用 pE 表示氧化还原电位?首先,pE 有明确的物理意义,pE=-lg[e] 表示相对电子浓度;其次,pE 每改变 1 个单位,[Ox]/[Red]就变化 10 倍(n=1),便于对比。 ● pE- lgc 图 一些氧化还原反应的电极电位与氧化剂、还原剂的浓度以及氢离子浓度有关,另一些反应只与氧化剂、 还原剂的浓度有关。pE 与氧化剂、还原剂浓度之间的关系可用 lgc-pE 图表示。现以 Fe3+-Fe2+-H2O 体 系的 lgc-pE 图为例加以说明。 当 Fe3+-Fe2+-H2O 体系中溶解的总铁浓度为 1×10-3mol/L 时,对于下列反应 Fe3+ + e === Fe2+, pE0 =13.05 pE = 13.05+lg[Fe3+]/[Fe2+] 当 pE<<pE0时,[Fe3+]<<[Fe2+] [Fe2+]≈ cTFe = 1×10-3 mol/L, lg[Fe2+]= -3 (a) 得: lg[Fe3+ ] = pE-16.05 (b) 当 pE>>pE0 时,[Fe3+]>>[Fe2+] [Fe3+]≈ cTFe = 1×10-3mol/L, lg[Fe3+]= -3 (c) 即得: lg[Fe2+] = 10.05-pE (d) 由(a),(b),(c),(d) 4 式可作[Fe3+]-[Fe2+]体系的 lgc-pE 图(图 3-8)
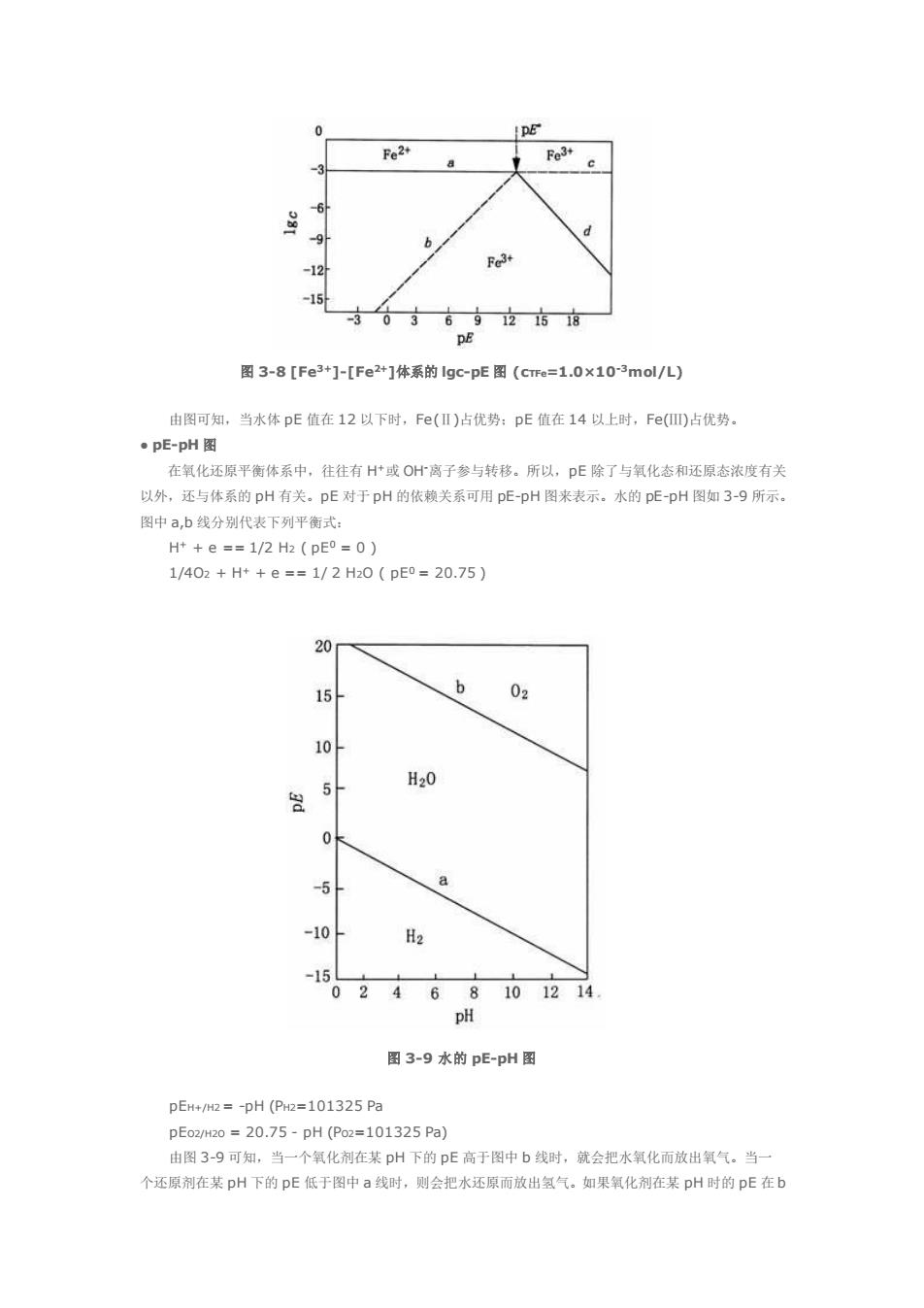
Fe3+ -15 -3036 921618 图3-8[Fe3+]-[Fe2*1体系的lgc-pE图(cme=1.0×10-3mol/L) 由图可知,当水体pE值在12以下时,Fe()占优势:pE值在14以上时,Fe(四)占优势。 ·pE-pH图 在氧化还原平衡体系中,往往有H或O什离子参与转移。所以,pE除了与氧化态和还原态浓度有关 以外,还与体系的pH有关。pE对于pH的依赖关系可用pE-pH图来表示。水的pEpH图如3-9所示 图中a,b线分别代表下列平衡式: H+e=1/2H(pE0=0) 1/402+H++e==1/2H20(pE0=20.75) 20 154 b 02 10 H20 0 -5 a -10 H2 -160246810214 图3-9水的pE-pH图 pEH+/=-pH(P=101325Pa pE02H20=20.75-pH(Po2=101325Pa) 由图3-9可知,当一个氧化剂在某pH下的pE高于图中b找时,就会把水氧化而放出氧气.当一 个还原剂在某pH下的pE低于图中a线时,则会把水还原而放出氢气。如果氧化剂在某pH时的pE在b
图 3-8 [Fe3+]-[Fe2+]体系的 lgc-pE 图 (cTFe=1.0×10-3mol/L) 由图可知,当水体 pE 值在 12 以下时,Fe(Ⅱ)占优势;pE 值在 14 以上时,Fe(Ⅲ)占优势。 ● pE-pH 图 在氧化还原平衡体系中,往往有 H+或 OH-离子参与转移。所以,pE 除了与氧化态和还原态浓度有关 以外,还与体系的 pH 有关。pE 对于 pH 的依赖关系可用 pE-pH 图来表示。水的 pE-pH 图如 3-9 所示。 图中 a,b 线分别代表下列平衡式: H+ + e == 1/2 H2 ( pE0 = 0 ) 1/4O2 + H+ + e == 1/ 2 H2O ( pE0 = 20.75 ) 图 3-9 水的 pE-pH 图 pEH+/H2 = -pH (PH2=101325 Pa pEO2/H2O = 20.75 - pH (PO2=101325 Pa) 由图 3-9 可知,当一个氧化剂在某 pH 下的 pE 高于图中 b 线时,就会把水氧化而放出氧气。当一 个还原剂在某 pH 下的 pE 低于图中 a 线时,则会把水还原而放出氢气。如果氧化剂在某 pH 时的 pE 在 b