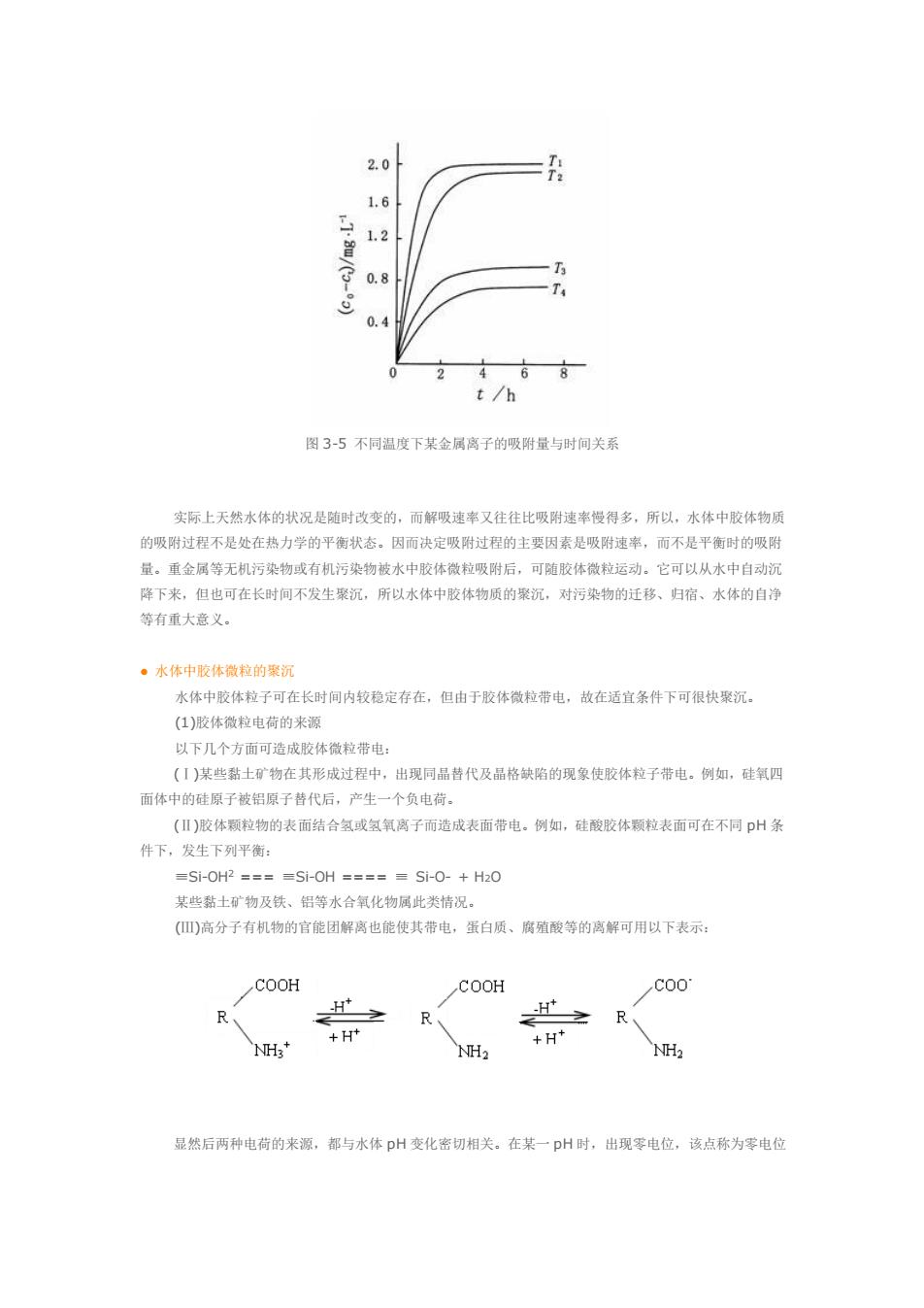
16 1.2 T 0.4 2 468 t/h 图3-5不同温度下某金属离子的吸附量与时间关系 实际上天然水体的状况是随时改变的,而解吸速率又往往比吸附速率慢得多,所以,水体中胶体物质 的吸附过程不是处在热力学的平衡状态。因而决定吸附过程的生要因素是吸附速半,而不是平衡时的吸附 量。重金属等无机污染物或有机污染物被水中胶体微拉吸附后。可随胶体微楚运动,它可以从水中自动沉 降下来,但也可在长时间不发生聚沉,所以水体中胶体物质的聚沉,对污染物的迁移、归宿、水体的自溶 等有重大意义。 。水体中骸体微粒的案沉 水体中胶体粒子可在长时间内校稳定存在,但由于胶体微粒带电,故在适宜条件下可很快聚沉。 (1)胶体微粒电荷的来源 以下几个方面可造成胶体微粒带电 (1)某些黏土矿物在其形成过程中,出现同品昔代及品格缺陷的现象使胶体粒子带电。例如,硅氧四 面体中的硅原子被铝原子替代后,产生一个负电荷, ()胶体颗粒物的表面结合氢或氢氧离子而造成表面带电。例如,硅酸胶体颗粒表面可在不同pH条 件下,发生下列平衡 =Si-0HP==-Si-0H=====Si-0-+H0 某些黏十矿物及铁、铝等水合氧化物属此类情况。 (高分子有机物的官能团解离也能使其带电,蛋白质、病殖酸等的离解可用以下表示。 COOH COOH c00 R H H R、 NH NH2 之R 显然后两种电荷的来源,都与水体pH变化密切相关。在某一pH时,出现零电位,该点称为零电位
图 3-5 不同温度下某金属离子的吸附量与时间关系 实际上天然水体的状况是随时改变的,而解吸速率又往往比吸附速率慢得多,所以,水体中胶体物质 的吸附过程不是处在热力学的平衡状态。因而决定吸附过程的主要因素是吸附速率,而不是平衡时的吸附 量。重金属等无机污染物或有机污染物被水中胶体微粒吸附后,可随胶体微粒运动。它可以从水中自动沉 降下来,但也可在长时间不发生聚沉,所以水体中胶体物质的聚沉,对污染物的迁移、归宿、水体的自净 等有重大意义。 ● 水体中胶体微粒的聚沉 水体中胶体粒子可在长时间内较稳定存在,但由于胶体微粒带电,故在适宜条件下可很快聚沉。 (1)胶体微粒电荷的来源 以下几个方面可造成胶体微粒带电: (Ⅰ)某些黏土矿物在其形成过程中,出现同晶替代及晶格缺陷的现象使胶体粒子带电。例如,硅氧四 面体中的硅原子被铝原子替代后,产生一个负电荷。 (Ⅱ)胶体颗粒物的表面结合氢或氢氧离子而造成表面带电。例如,硅酸胶体颗粒表面可在不同 pH 条 件下,发生下列平衡: ≡Si-OH2 === ≡Si-OH ==== ≡ Si-O- + H2O 某些黏土矿物及铁、铝等水合氧化物属此类情况。 (Ⅲ)高分子有机物的官能团解离也能使其带电,蛋白质、腐殖酸等的离解可用以下表示: 显然后两种电荷的来源,都与水体 pH 变化密切相关。在某一 pH 时,出现零电位,该点称为零电位

点,简称零电点,相应的pH值简称pH2pC(见表3-8).因此水体pH对胶体吸附有较大的影响。一方面。 DH决定着胶体的性质:另一方面,重金属的存在形态也与水体H有关, 表3-8水体中常见物质的DHzDC 5 0 2.1 长石 20 2.4 钠长石 (V)胶体微粒表面结合或吸附水中某些离子、配高子或有机高子等,使题拉表面带电。例 FeO(OH)(s)+HPO42 FeOHPO+(s)+OH- (2)水体中胶体微粒的双电层特征 即盐土广物微拉的型由层结均为州道明胶体的结的。盐士矿物特拉的老面指负由特,空吸附游液中 正离子(称为反离子)。由于离子的热运动,正离子将扩散分布在微粒界面的周用。图3-6中,界面NM是 黏土矿物微粒表面的一部分,符号”+“表示被吸附的正离子.实际界面周围的溶液中有正离子,也有负离 子:因微粒负电场作用,正高子过剩,显然与界面NM距离越远的液面,由于微粒电场力不断诚弱,正离 子过利趋势也越小,直至为零。这样由界面 图3-6黏士旷物微粒双电层及其反高子扩散分布示意图 NM和同它距离为d正离子过剩刚刚为零的液面CD,构成了微粒扩散双电层。实验证明,与微粒界 而紧靠的NM至AB液层,将随微粒一起运动,称为不流动层(固定层):其厚度为δ,约与离子大小相近。 而离界面稍远的AB至CD液层,不跟微粒一起运动,称为流动液层(付扩散层),其厚度为d-百,曲线NC 表示相对界面不同距离的液面电位,液面CD电中性,设其电位为零,并作为衡量其他液面电位的基酒 界面NM电位为E,称为胶体微粒总电位。不流动层与流动层交界液面AB的电位为5,称为胶体微粒的ξ 电位或电动电位。不流动液层中总有一部分与微粒电性相反的离子,所以E电位的绝对值小于总电位E的 绝对值。由于同种胶体微粒具有相同的ξ电位,当它们被此接近时,在静电斥力作用下分开,故胶体微 可长时间稳定存在而不发生聚沉
点,简称零电点,相应的 pH 值简称 pHzpc (见表 3-8)。因此水体 pH 对胶体吸附有较大的影响。一方面, pH 决定着胶体的性质;另一方面,重金属的存在形态也与水体 pH 有关。 表 3-8 水体中常见物质的 pHzpc (Ⅳ)胶体微粒表面结合或吸附水中某些离子、配离子或有机离子等,使颗粒表面带电。例 FeO(OH)(s) + HPO4 2- = FeOHPO4 - (s) + OH- (2)水体中胶体微粒的双电层特征 现以黏土矿物微粒的双电层结构为例说明胶体的结构。黏土矿物微粒的表面带负电荷,它吸附溶液中 正离子(称为反离子)。由于离子的热运动,正离子将扩散分布在微粒界面的周围。图 3-6 中,界面 NM 是 黏土矿物微粒表面的一部分,符号"+"表示被吸附的正离子。实际界面周围的溶液中有正离子,也有负离 子;因微粒负电场作用,正离子过剩,显然与界面 NM 距离越远的液面,由于微粒电场力不断减弱,正离 子过剩趋势也越小,直至为零。这样由界面 图 3-6 黏土矿物微粒双电层及其反离子扩散分布示意图 NM 和同它距离为 d 正离子过剩刚刚为零的液面 CD,构成了微粒扩散双电层。实验证明,与微粒界 面紧靠的 NM 至 AB 液层,将随微粒一起运动,称为不流动层(固定层);其厚度为 δ,约与离子大小相近。 而离界面稍远的 AB 至 CD 液层,不跟微粒一起运动,称为流动液层(扩散层),其厚度为 d-δ。曲线 NC 表示相对界面不同距离的液面电位,液面 CD 呈电中性,设其电位为零,并作为衡量其他液面电位的基准。 界面 NM 电位为 E,称为胶体微粒总电位。不流动层与流动层交界液面 AB 的电位为 ξ,称为胶体微粒的 ξ 电位或电动电位。不流动液层中总有一部分与微粒电性相反的离子,所以 ξ 电位的绝对值小于总电位 E 的 绝对值。由于同种胶体微粒具有相同的 ξ 电位,当它们彼此接近时,在静电斥力作用下分开,故胶体微粒 可长时间稳定存在而不发生聚沉

实际上水体中胶体结构是很复杂的。侧如,黏土矿物大多数为薄板状结构,具有一定厚度,故除有 面表面外,还有边缘表面。在天然水体中黏土矿物板面常垦电负性,边面则垦正电性,使双电层的结构复 杂化,常表现出板面与另一微粒的边面相互吸引而结合,具有自然雾凝的特征。 高分子电解质如腐殖酸、蛋白质等,其电荷是由官能团的离解产生的,离解度即电荷值由水体p州 监决定,其表面电位还与官能团的数量和分布特征有关。双电层的结构也与围体表面的双电层结构不同 铁、铝、锰、硅等的水合氧化物或固体氧化物,其表面电荷是因结合氢离子或氢氧离子产生的,因而 表而电荷强烈地依懒于溶液的pH值。在天然水体中时常呈电负性,在低pH值时可呈正电性,在固定pH 值时,表面上有恒定的电位,这种双电层有明显的两性性质,因此零电点是其主要参数。 (3)胶体微粒的聚沉 胶体微粒的聚沉是指胶体厕粒通过碰撞结合成聚集体而发生沉淀现象,这现象也称凝聚。彩响胶体 微粒聚沉的因素是多种多样的,包括电解质的浓度、微粒的沫度、水体温度、p州值及流动状况、带相反电 荷微粒何相互作用等,其中主要因素是电解质浓度。从微粒本身结构看,微粒带同号电荷及微粒周用有水 化膜是使其稳定的两个士要原因。若消除这两个因素,微粒便可聚沉 图3-7是电解质浓度对ξ电位的影响,若曲线NC表示在带负电荷的黏土溶液中,没有加入电解质时 颜拉图围各液面的电位分布。当溶液加入电解质后,其中正离子会更多地被微粒吸附讲固定层,而使£申 拉绝对值下降,即由ξ下降到子,同时由于固定层中正离子增多,而扩散层中正离子相对减少,引起扩 双电层厚度变薄(由d变为d)。如果E电位降到不足以排斥胶体微粒相互碰撞时的分子间作用力,则微料 会聚集变大,并在重力作用下沉降。胶体微粒开始明显聚沉的E电位,称为临界电位。若加入的电解顺离 子能被微粒大量吸附到圆定层内 ,可使电位减为零,甚至变号。若ξ电位等于零时,表明胶体微粒及其 同定层的整体垦现电中性面处于等电状态,若E电位变号后绝对值较大,又可阻止胶体微拉的聚沉,总之 E电位大约在士0.0V时,胶体微粒在溶液中相当稳定。引入电解质到足够浓度,E电位变化到临界电位(大 的士0.03V)时,胶体微粒就会开始明显聚沉,且电解质中影响电位的离子价数越高,所起的凝聚作用越 强。 图3-7电解质对ξ电位的影 某些胶体微粒(如有机高分子胶体微粒)本身具有一定的亲水性,直接吸附水分子形成水化膜。对于这
实际上水体中胶体结构是很复杂的。例如,黏土矿物大多数为薄板状结构,具有一定厚度,故除有板 面表面外,还有边缘表面。在天然水体中黏土矿物板面常呈电负性,边面则呈正电性,使双电层的结构复 杂化,常表现出板面与另一微粒的边面相互吸引而结合,具有自然絮凝的特征。 高分子电解质如腐殖酸、蛋白质等,其电荷是由官能团的离解产生的,离解度即电荷值由水体 pH 值决定,其表面电位还与官能团的数量和分布特征有关。双电层的结构也与固体表面的双电层结构不同。 铁、铝、锰、硅等的水合氧化物或固体氧化物,其表面电荷是因结合氢离子或氢氧离子产生的,因而 表面电荷强烈地依赖于溶液的 pH 值。在天然水体中时常呈电负性,在低 pH 值时可呈正电性,在固定 pH 值时,表面上有恒定的电位,这种双电层有明显的两性性质,因此零电点是其主要参数。 (3)胶体微粒的聚沉 胶体微粒的聚沉是指胶体颗粒通过碰撞结合成聚集体而发生沉淀现象,这现象也称凝聚。影响胶体 微粒聚沉的因素是多种多样的,包括电解质的浓度、微粒的浓度、水体温度、pH 值及流动状况、带相反电 荷微粒间相互作用等,其中主要因素是电解质浓度。从微粒本身结构看,微粒带同号电荷及微粒周围有水 化膜是使其稳定的两个主要原因。若消除这两个因素,微粒便可聚沉。 图 3-7 是电解质浓度对 ξ 电位的影响,若曲线 NC 表示在带负电荷的黏土溶液中,没有加入电解质时 颗粒周围各液面的电位分布,当溶液加入电解质后,其中正离子会更多地被微粒吸附进固定层,而使 ξ 电 位绝对值下降,即由 ξ 下降到 ξ′,同时由于固定层中正离子增多,而扩散层中正离子相对减少,引起扩散 双电层厚度变薄(由 d 变为 d′)。如果 ξ 电位降到不足以排斥胶体微粒相互碰撞时的分子间作用力,则微粒 会聚集变大,并在重力作用下沉降。胶体微粒开始明显聚沉的 ξ 电位,称为临界电位。若加入的电解质离 子能被微粒大量吸附到固定层内,可使 ξ 电位减为零,甚至变号。若 ξ 电位等于零时,表明胶体微粒及其 固定层的整体呈现电中性而处于等电状态。若 ξ 电位变号后绝对值较大,又可阻止胶体微粒的聚沉。总之, ξ 电位大约在±0.07V 时,胶体微粒在溶液中相当稳定。引入电解质到足够浓度,ξ 电位变化到临界电位(大 约±0.03 V)时,胶体微粒就会开始明显聚沉,且电解质中影响 ξ 电位的离子价数越高,所起的凝聚作用越 强。 图 3-7 电解质对 ξ 电位的影响 某些胶体微粒(如有机高分子胶体微粒)本身具有一定的亲水性,直接吸附水分子形成水化膜。对于这

类胶体的聚沉来说,要降低电位,但更重要的是要去除水化膜,否则带有水化膜的有机胶体微粒相互 距离较大,分子间作用力很弱,难以聚沉。一般在有大量电解质存在时,可以满足上述两个方面的需要, 使有机胶体微粒在水中聚沉 胶体粒子除能聚集成沉淀外,还能形成松散状絮状物,该过程称为胶体微粒的絮凝,絮状物称凝絮物 例如,腐殖质分子中的我基和酚羟基可与水合氧化铁胶体微粒表而的铁整合,而腐殖质分子中可供整合的 成分很多,这样有可能形成胶体微粒腐殖质胶体微粒的庞大聚集体,从而絮凝沉降。 实际水体中微粒可出现多种方式的聚沉和絮凝作用。影响胶体凝聚的因素是复杂的。除电解质外 还有胶体微粒的浓度、水体的温度、pH值及流动状况、带相反电性的胶体微粒的相互作用、光的作用等因 素。 ·胶体微粒的吸附和聚沉对污染物的响 吸附作用可垫制水体中金属离子的浓度。胶体的吸附作用是使许多微量金属从饱和的天然水中转入因 相的最重要的途径。胶体的吸附作用在很大程度上控制若微量金属在水环墙中的分布和富集状况。大量窗 料表明,在水环境中所有富含胶体的沉积物由于吸附作用几乎都富集C? NR. Ba24、Zn24、Pb2 可、U等金属,加帝纳(0.Gardiner,1974)的试验表明,底泥和悬浮物对Cd2+的吸附作用及其可能发生的 解吸作用是控制问水中C+浓度的主要因素。很多学者研究了水环境中胶体对无机二价汞的吸附特征。颜 尼enne)指出,铁和锰的水合氧化物对Hg2*的吸附作用能有效地控制Hg2的浓度.安德逊(Anderson) 发现,氧化铁能吸附大量Hg2+,尤其是在pH6.5~7.0时, 不同吸附剂对金属离子的吸附有较大的差别。P.A.Krenkel和E.B.Shin等研究了各种天然和人工合 成的吸附剂对HgC的吸附作用,其吸附能力大致顺序是:含硫的沉积物(还原态的)>商业去污剂(硅的混 合物、活性碳)>三维黏士矿物(伊利石、蒙脱石)>含蛋白去污剂>铁,锰氧化物及不含硫的天然有机物 不含硫但含胺的合成有机去污剂、二维黏土矿物和细砂。若以每分钟每克吸附剂所吸附的HC2的微克数 多少来排列,则吸附顺序为:硫醇(84.2)>>伊利石(65.3)>蒙脱石(35.7)>胺类化合物(10.5)>高龄石 (9.7)>含碳基的有机物(7.3)>细砂(2.9)>中砂(1.7)>粗砂(1.6) 高广生、陈静生研究了我国主要河流(珠江广州段、长江南京段、黄河花园口段、松花江和黑龙江同 江设)县浮物的地球化学性质与对锅离子吸附作用的相关性和地域分布规律,认为我国主要河流悬浮物的有 效载体阳离子交换量(见表3-9)与其黏士矿物组成(见表3-10)有很好的相关性,并且与相应流域代表性 壤的黏土矿物类型、硅铝分子比率和胡敏酸/富里酸之比值也有较好的相关性。 水体DH对吸附剂吸附重金属离子有一定的响。王略等(1983年)研究了金沙江题粒物对Cu2+ Zn2、C、C02。NP:的吸附作用。结果表明,江水pH值是控制金属离子向圆相证移的主要因。 颗粒物的吸附作用使水中金属离子在较低的H值下向固相迁移。总吸附量随DH增高而增大。各元素均 有一临界D州值,超过了该值,离子的水解、沉淀则起主要作用。颗粒物的粒度和浓度及几种离子共存时 对吸附有影响
类胶体的聚沉来说,虽要降低 ξ 电位,但更重要的是要去除水化膜,否则带有水化膜的有机胶体微粒相互 距离较大,分子间作用力很弱,难以聚沉。一般在有大量电解质存在时,可以满足上述两个方面的需要, 使有机胶体微粒在水中聚沉。 胶体粒子除能聚集成沉淀外,还能形成松散状絮状物,该过程称为胶体微粒的絮凝,絮状物称凝絮物。 例如,腐殖质分子中的羧基和酚羟基可与水合氧化铁胶体微粒表面的铁螯合,而腐殖质分子中可供螯合的 成分很多,这样有可能形成胶体微粒 腐殖质 胶体微粒的庞大聚集体,从而絮凝沉降。 实际水体中微粒间可出现多种方式的聚沉和絮凝作用。影响胶体凝聚的因素是复杂的。除电解质外, 还有胶体微粒的浓度、水体的温度、pH 值及流动状况、带相反电性的胶体微粒的相互作用、光的作用等因 素。 ● 胶体微粒的吸附和聚沉对污染物的影响 吸附作用可控制水体中金属离子的浓度。胶体的吸附作用是使许多微量金属从饱和的天然水中转入固 相的最重要的途径。胶体的吸附作用在很大程度上控制着微量金属在水环境中的分布和富集状况。大量资 料表明,在水环境中所有富含胶体的沉积物由于吸附作用几乎都富集 Cu2+、Ni2+、Ba2+、Zn2+、Pb2+、 Tl、U 等金属。加帝纳(J.Gardiner,1974)的试验表明,底泥和悬浮物对 Cd2+的吸附作用及其可能发生的 解吸作用是控制河水中 Cd2+浓度的主要因素。很多学者研究了水环境中胶体对无机二价汞的吸附特征。颜 尼(Jenne)指出,铁和锰的水合氧化物对 Hg2+的吸附作用能有效地控制 Hg2+的浓度。安德逊(Anderson) 发现,氧化铁能吸附大量 Hg2+,尤其是在 pH 6.5~7.0 时。 不同吸附剂对金属离子的吸附有较大的差别。P.A.Krenkel 和 E.B.Shin 等研究了各种天然和人工合 成的吸附剂对 HgCl2的吸附作用,其吸附能力大致顺序是:含硫的沉积物(还原态的)>商业去污剂(硅的混 合物、活性碳)>三维黏土矿物(伊利石、蒙脱石)>含蛋白去污剂>铁、锰氧化物及不含硫的天然有机物> 不含硫但含胺的合成有机去污剂、二维黏土矿物和细砂。若以每分钟每克吸附剂所吸附的 HgCl2的微克数 多少来排列,则吸附顺序为:硫醇(84.2)>>伊利石(65.3)>蒙脱石(35.7)>胺类化合物(10.5)>高岭石 (9.7)>含碳基的有机物(7.3)>细砂(2.9)>中砂(1.7)>粗砂(1.6)。 高广生、陈静生研究了我国主要河流(珠江广州段、长江南京段、黄河花园口段、松花江和黑龙江同 江段)悬浮物的地球化学性质与对镉离子吸附作用的相关性和地域分布规律,认为我国主要河流悬浮物的有 效载体阳离子交换量(见表 3-9)与其黏土矿物组成(见表 3-10)有很好的相关性,并且与相应流域代表性土 壤的黏土矿物类型、硅铝分子比率和胡敏酸/富里酸之比值也有较好的相关性。 水体 pH 对吸附剂吸附重金属离子有一定的影响。王晓蓉等(1983 年)研究了金沙江颗粒物对 Cu2+、 Zn2+、Cd2+、Co2+、Ni2+的吸附作用。结果表明,江水 pH 值是控制金属离子向固相迁移的主要原因。 颗粒物的吸附作用使水中金属离子在较低的 pH 值下向固相迁移。总吸附量随 pH 增高而增大。各元素均 有一临界 pH 值,超过了该值,离子的水解、沉淀则起主要作用。颗粒物的粒度和浓度及几种离子共存时 对吸附有影响
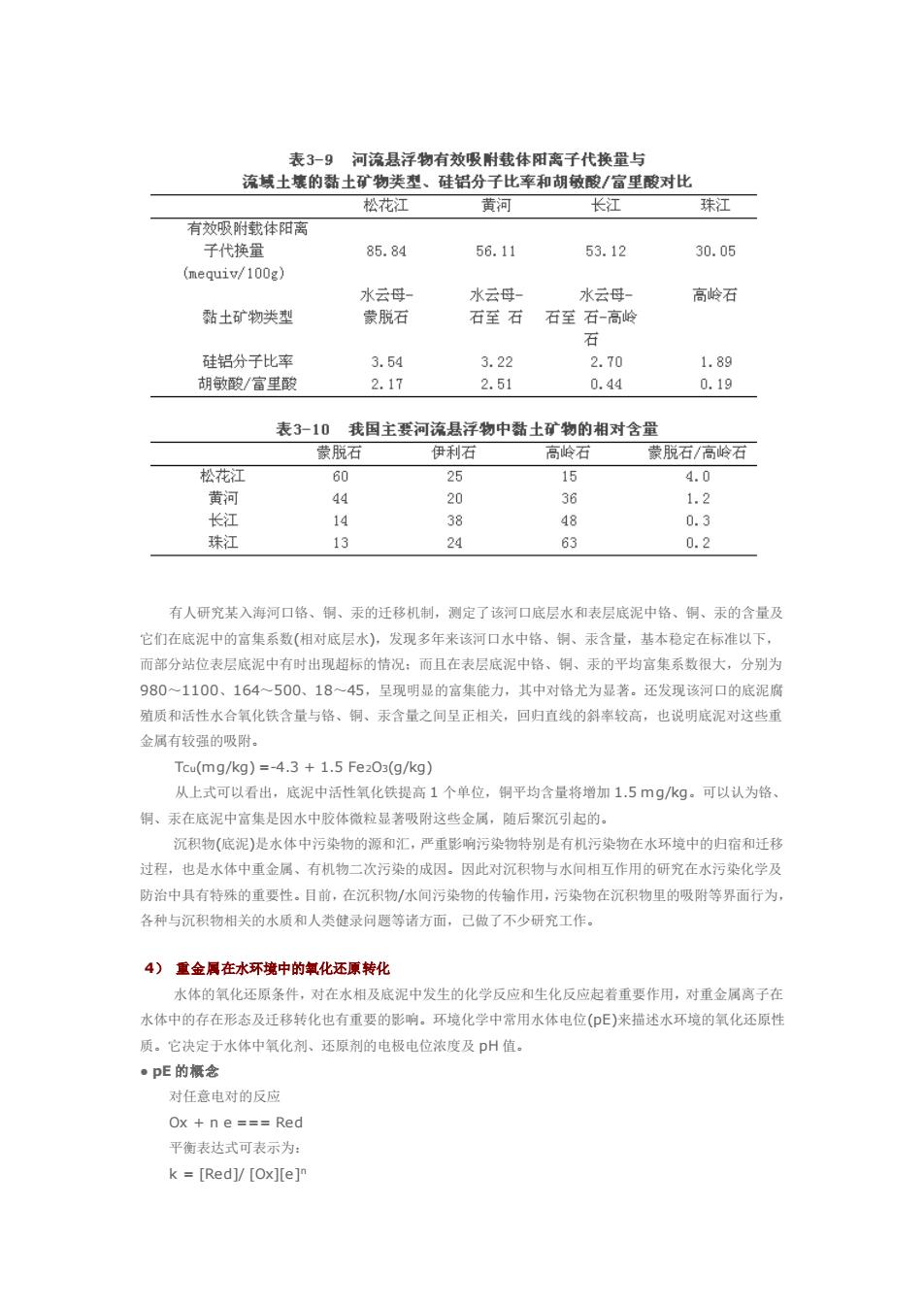
表39河流县浮物有效吸附裁休阳离千代掩量与 流域土壤的黏土矿物类型、硅铝分子比率和胡敏酸/富里酸对比 松花江 黄河 有效吸附载体阳离 长江 珠江 子代换量 85.84 56.11 53.12 30.05 (mequiv/100g 水云母 高岭石 黏土矿物类型 蒙脱石 石至石石至石-高岭 3.22 1.89 2.17 2.51 0.44 0.1g 表3-10 我国主要河流县浮物中黏士矿物的相对含量 蒙脱石 伊利石 高龄石 蒙脱石/高岭石 松花江 60 25 15 4.0 44 20 36 1.2 长 14 38 48 0.3 珠江 13 24 63 0.2 有人研究某入海河口路、铜、汞的迁移机制,测定了该河口底层水和表层底泥中格、制、汞的含量及 它们在底泥中的富集系数(相对底层水)。发现多年来该河口水中络、铜、汞含量,基本稳定在标准以下 而部分站位表层底泥中有时出现超标的情况:而且在表尽底泥中铬、铜、汞的平均富集系数很大,分别为 9801100、164~500、18~45.是现明显的富集能力,其中对路尤为显著。还发现该河口的底泥腐 殖质和活性水合氧化铁含量与格、铜、汞含量之间呈正相关,回归直线的斜率较高,也说明底泥对这些重 金属有较强的吸附, Tcu(mg/kg)=-4.3+1.5Fe203(g/kg) 从上式可以看出,底泥中活性氧化铁提高1个单位,铜平均含量将增加1.5mg/kg可以认为 铜、汞在底泥中富集是因水中胶体微粒显著吸附这些金属,随后聚沉引起的。 沉积物(底泥)是水体中污染物的源和汇,严重影南污染物特别是有机污染物在水环境中的归宿和迁移 过程,也是水体中重金属、有机物二次污染的成因。因此对沉积物与水间相互作用的研究在水污染化学及 防治中具有特殊的重要性。目前,在沉积物/水间污染物的传输作用,污染物在沉积物里的吸附等界面行为 各种与汇积物相关的水质和人类健录问题等诸方面,已做了不少研究工作, 4)重金属在水环境中的氢化还原转化 水体的氧化还原条件,对在水相及底泥中发生的化学反应和生化反应起着重要作用。对重金属离子在 水体中的存在形态及迁移转化也有重要的影响。环境化学中常用水体电位(E)来描述水环境的氧化还原性 质。它决定于水体中氧化剂、还原剂的电极电位浓度及DH值。 pE的根念 对任意电对的反应 Ox+ne===Red 平衡表达式可表示为: k=[Red]/[Ox][e]
有人研究某入海河口铬、铜、汞的迁移机制,测定了该河口底层水和表层底泥中铬、铜、汞的含量及 它们在底泥中的富集系数(相对底层水),发现多年来该河口水中铬、铜、汞含量,基本稳定在标准以下, 而部分站位表层底泥中有时出现超标的情况;而且在表层底泥中铬、铜、汞的平均富集系数很大,分别为 980~1100、164~500、18~45,呈现明显的富集能力,其中对铬尤为显著。还发现该河口的底泥腐 殖质和活性水合氧化铁含量与铬、铜、汞含量之间呈正相关,回归直线的斜率较高,也说明底泥对这些重 金属有较强的吸附。 TCu(mg/kg) =-4.3 + 1.5 Fe2O3(g/kg) 从上式可以看出,底泥中活性氧化铁提高 1 个单位,铜平均含量将增加 1.5 mg/kg。可以认为铬、 铜、汞在底泥中富集是因水中胶体微粒显著吸附这些金属,随后聚沉引起的。 沉积物(底泥)是水体中污染物的源和汇,严重影响污染物特别是有机污染物在水环境中的归宿和迁移 过程,也是水体中重金属、有机物二次污染的成因。因此对沉积物与水间相互作用的研究在水污染化学及 防治中具有特殊的重要性。目前,在沉积物/水间污染物的传输作用,污染物在沉积物里的吸附等界面行为, 各种与沉积物相关的水质和人类健录问题等诸方面,已做了不少研究工作。 4) 重金属在水环境中的氧化还原转化 水体的氧化还原条件,对在水相及底泥中发生的化学反应和生化反应起着重要作用,对重金属离子在 水体中的存在形态及迁移转化也有重要的影响。环境化学中常用水体电位(pE)来描述水环境的氧化还原性 质。它决定于水体中氧化剂、还原剂的电极电位浓度及 pH 值。 ● pE 的概念 对任意电对的反应 Ox + n e === Red 平衡表达式可表示为: k = [Red]/ [Ox][e]n