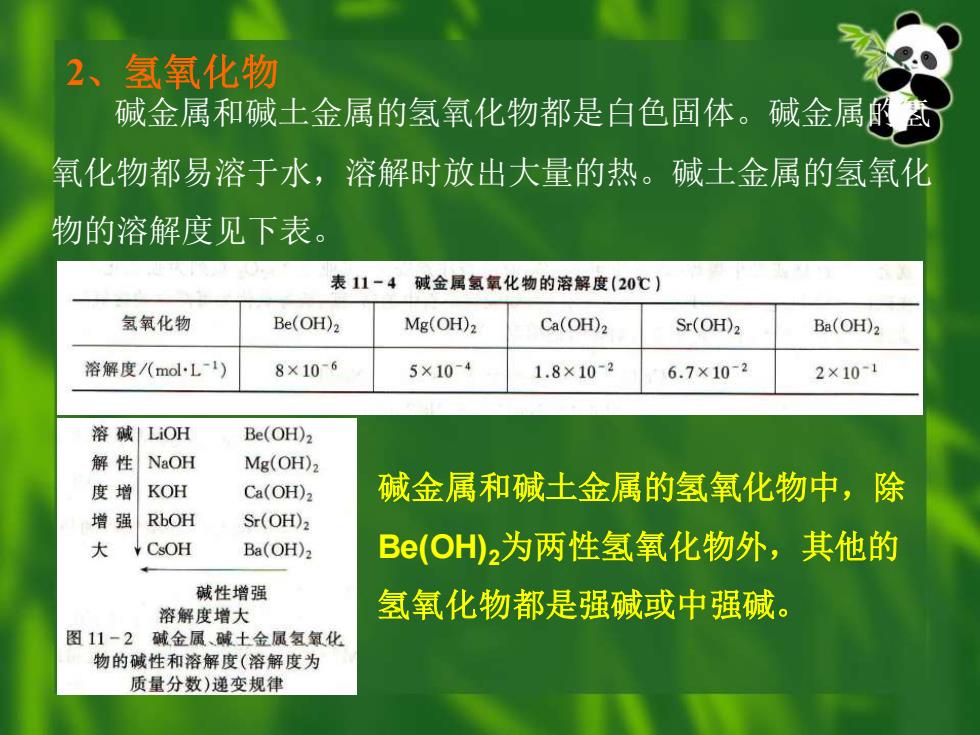
2、氢氧化物 碱金属和碱土金属的氢氧化物都是白色固体。碱金属意 氧化物都易溶于水,溶解时放出大量的热。碱土金属的氢氧化 物的溶解度见下表。 表11-4碱金属氢氧化物的溶解度(20℃】 氢氧化物 Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2 溶解度/(molL-1) 8×10-6 5×10-4 1.8×102 6.7×10-2 2×10-1 溶碱」LiOH Be(OH)2 解性NaOH Mg(OH)2 度增KOH Ca(OH)2 碱金属和碱土金属的氢氧化物中,除 增强RbOH Sr(OH)2 大 CSOH Ba(OH)2 Be(OH2为两性氢氧化物外,其他的 碱性增强 溶解度增大 氢氧化物都是强碱或中强碱。 图11-2碱金属、碱土金鼠氢氧化 物的碱性和溶解度(溶解度为 质量分数)递变规律
2、氢氧化物 碱金属和碱土金属的氢氧化物都是白色固体。碱金属的氢 氧化物都易溶于水,溶解时放出大量的热。碱土金属的氢氧化 物的溶解度见下表。 碱金属和碱土金属的氢氧化物中,除 Be(OH)2为两性氢氧化物外,其他的 氢氧化物都是强碱或中强碱
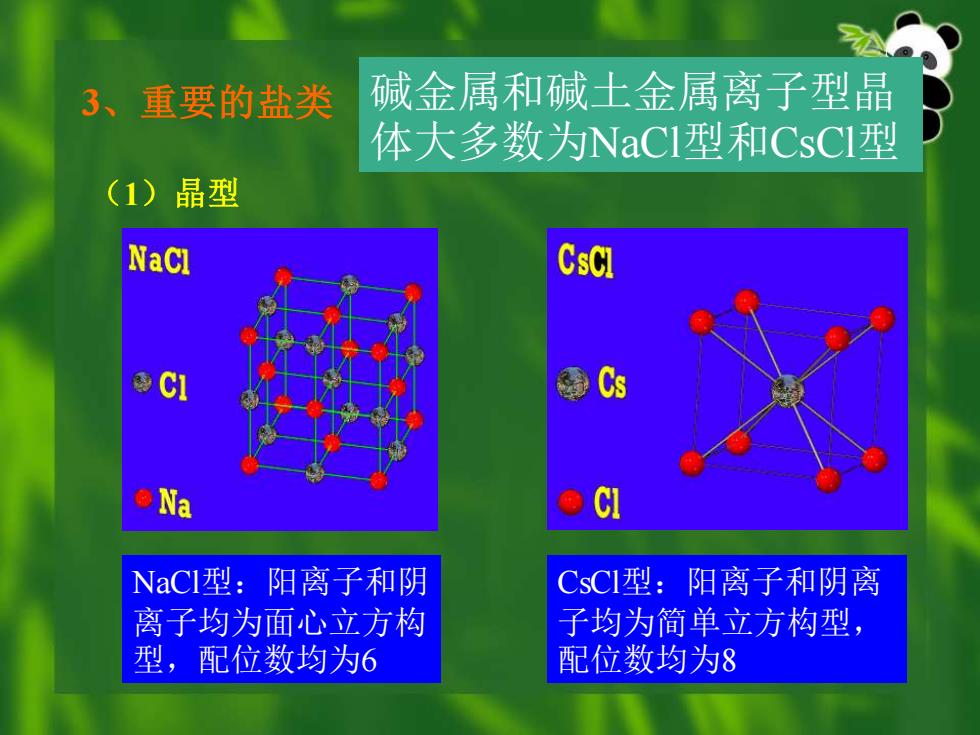
3、 重要的盐类 碱金属和碱土金属离子型晶 体大多数为NaCI型和CsCI型 (1)晶型 NaCl CsCl Cs ●Na NaCI型:阳离子和阴 CsCI型:阳离子和阴离 离子均为面心立方构 子均为简单立方构型, 型,配位数均为6 配位数均为8
3、重要的盐类 (1)晶型 NaCl型:阳离子和阴 离子均为面心立方构 型,配位数均为6 CsCl型:阳离子和阴离 子均为简单立方构型, 配位数均为8 碱金属和碱土金属离子型晶 体大多数为NaCl型和CsCl型

(2)溶解性 IA族 锂盐:氟化锂LP、碳酸锂LiCO、 磷酸锂LiP05句10 钠盐:六羟基锑酸钠NaSb(OHl(白) 醋酸铀酰锌钠NaUO,)(CH,COO)。:9H,O(黄绿) 钾盐: KC10:(白色)、CL0(酒石酸氢钾,白色) K[PtC1](淡黄色)、KNa[CoNO):](亮黄色) KIB(C H) (四苯硼酸钾,白色) ⅡA族 碳酸盐:都难溶 硫酸盐: 以BaS0最难溶,MgS0,易溶 草酸盐: 以GaC0,的最小,它是所有钙盐中溶解度最小的。 铬酸盐:除铬酸锁易溶外,其他的难溶
(2)溶解性 锂盐:氟化锂 LiF、碳酸锂Li2CO3、 磷酸锂Li3PO4 .5H2O 钠盐:六羟基锑酸钠 Na[Sb(OH)6 ] (白) 醋酸铀酰锌钠NaZn(UO2 )3 (CH3COO)9·9H2O(黄绿) 钾盐:KClO4(白色)、KHC4H4O6(酒石酸氢钾,白色) K4[PtCl6](淡黄色)、 K2Na[Co(NO2)6](亮黄色) K[B(C6H5)4](四苯硼酸钾,白色) 碳酸盐:都难溶 硫酸盐:以BaSO4最难溶,MgSO4易溶 草酸盐:以CaC2O4的最小,它是所有钙盐中溶解度最小的。 铬酸盐:除铬酸镁易溶外,其他的难溶。 ⅠA 族 ⅡA族

(3)热稳定性 碱金属盐一般具有较高的热稳定性,只有硝酸盐稳定性差, 加热易分解。 硝酸盐的分解: NO =2Li0+4N0↑+O2↑ 2M NO ==2MO+4NO2↑+O,↑M=碱土离子) 2NaNO3=2NaNO2+O2↑(K、Rb、Cs的盐分解类似) 碱土金属盐类的热稳定性较碱金属相应盐类的差
(3)热稳定性 硝酸盐的分解: 4LiNO3===2Li2O+4NO2↑+O2 ↑ 2M(NO3 )2===2MO+4NO2 ↑ +O2 ↑(M=碱土离子) 2NaNO3=2NaNO2+O2 ↑ (K、Rb、Cs的盐分解类似) 碱金属盐一般具有较高的热稳定性,只有硝酸盐稳定性差, 加热易分解。 碱土金属盐类的热稳定性较碱金属相应盐类的差

四、锂、铍的特殊性和对角线规则 在周期表中,在第二周期和第三周期元素中,处于对 角线位置上的三对元素:Li一Mg、Be一Al、B一Si,它们的 性质具有相似性。这种相似性称为“对角线规则”。 这种相似性主要体现在下列三组元素之间: Be B Na Mg
四、锂、铍的特殊性和对角线规则 在周期表中,在第二周期和第三周期元素中,处于对 角线位置上的三对元素:Li—Mg、Be—Al、B—Si,它们的 性质具有相似性。这种相似性称为“对角线规则”。 这种相似性主要体现在下列三组元素之间: Li Be B C Na Mg Al Si