
二、$区元素的重要化合物 1、氧化物 正常氧化物 过氧化物 超氧化物 臭氧化物 Li,O、MO(M Na202 MO,(M=K MO2M-K、 碱土金属) BaO2 Rb、Cs Rb、CS 结 构 1eo》
二、s区元素的重要化合物 1、氧化物 正常氧化物 过氧化物 超氧化物 臭氧化物 Li2O、MO (M = 碱土金属) Na2O2、 BaO2 MO2 (M = K、 Rb、Cs) MO3 (M=K、 Rb、Cs) :O: ¨ ¨ 2- :O—O: ¨ ¨ ¨ ¨ 2- :O—O: • • • ¨ ¨ - O O O - 3 5 结 构

Li、Ⅱ金属与空气作用或由碳酸盐加 (1)正常氧化物 热分解时均生成氧化物: 4M+02===4M0 (M碱金属,常温) 6Li+N2=2LiN(常温) 制备 △ 2M+0,=2MG (M=碱土) △ MC0===MO-+C0, (M=碱土 M,O+H,O 2MOH (M=碱金属》 M0+C0,= MC0(M=碱金属) 性质 MO+HO=M(OH)。 (M=碱土金属》 M0+C0,=MC01 (M=碱土金属) BeO+NaOH=NaBe(OI),(铍酸钠 Be0+2HC1=BeC1,+H,O
Li、ⅡA金属与空气作用或由碳酸盐加 热分解时均生成氧化物: 4M+O2====4M2O (M=碱金属,常温) 6Li + N2 ====2Li3N (常温) △ 2M+O2====2MO (M=碱土) △ MCO3====MO+CO2↑ (M=碱土) M2O+H2O = 2MOH (M=碱金属) M2O+CO2 = M2CO3(M=碱金属) MO+H2O=M(OH)2 (M=碱土金属) MO+CO2 = MCO3 (M=碱土金属) BeO+NaOH=Na2Be(OH)4(铍酸钠) BeO+2HCl=BeCl2+H2O 制备 性质 (1)正常氧化物
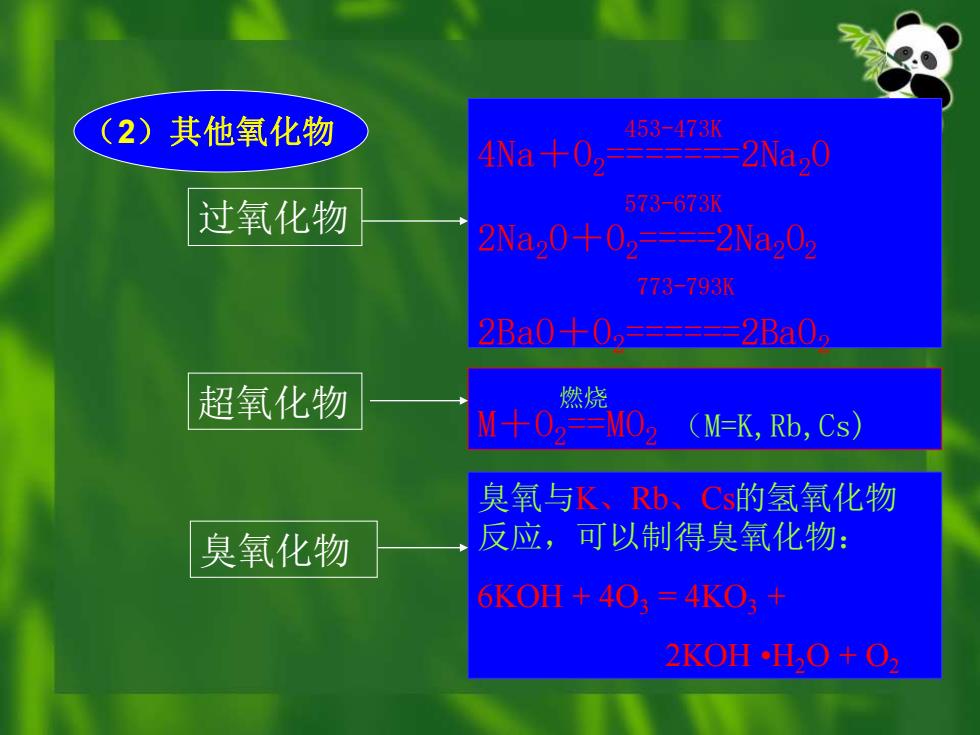
(2)其他氧化物 453473k 4Na+0 2Na,0 过氧化物 573-673K 2Na0+02-==2Na202 773-793K 2Ba0-+0,=====2Ba0 超氧化物 燃烧 M十0w=M0 (M=K,Rb,Cs) 臭氧与K、Rb、Cs的氢氧化物 臭氧化物 反应,可以制得臭氧化物: 6KOH+403=4KO3+ 2KOHH,O+O
453-473K 4Na+O2=======2Na2O 573-673K 2Na2O+O2====2Na2O2 773-793K 2BaO+O2======2BaO2 燃烧 M+O2==MO2 (M=K,Rb,Cs) 臭氧与K、Rb、Cs的氢氧化物 反应,可以制得臭氧化物: 6KOH + 4O3 = 4KO3 + 2KOH •H2O + O2 臭氧化物 超氧化物 过氧化物 (2)其他氧化物

(3)、氧化物 Na202+2H20=H02+2Na0H 的性质比较 2H202=2H20+02↑ 2M02+2H0=02+H02+2MOH 与水反应 2M03+2H0=202+H02+2M0H M20+CO2 M2CO2 与CO,反应 2M202+C02==2M2C03+02 4M02+2C02=2MC03+302 强氧化性 Cr2O3+3Na2O2==2Na2CrO4+Na2O MnO2+Na2O2==Na2MnO 过氧化物用于把某些 难溶氧化物氧化为高 价的易溶物:
(3)、氧化物 的性质比较 Na2O2+2H2O=H2O2+2NaOH 2H2O2=2H2O+O2↑ 2MO2+2H2O=O2+H2O2+2MOH 2MO3+2H2O=2O2+H2O2+2MOH 与水反应 M2O+CO2 = M2CO3 2M2O2+CO2==2M2CO3+O2 4MO2+2CO2=2M2CO3+3O2 与CO2反应 Cr2O3+3Na2O2==2Na2CrO4+Na2O MnO2+Na2O2==Na2MnO4 强氧化性 过氧化物用于把某些 难溶氧化物氧化为高 价的易溶物:

(4)、氧化物 碱土金属的Be0,MgO具有很高的熔点 的主要用途 和硬度,用于制耐火材料和金属髓 瓷。Ca0俗称石灰或生石灰,作建筑 材料,也用做干燥剂, 炼钢工业上用 碱土氧化物 于除去Si、P杂质△ 过氧化物N超化物、臭氧化物都是 氧化剂 强氧化,烈0+P,0=Cag(P0)2 由于它们的强氧化性,可用于纸张、 漂白剂 织物等的漂白剂 利用它们与二氧化碳反应生成氧气的 供氧剂 性质作为潜水、登山、高空作业的供 氧剂 引火剂 过氧化钡常用于爆破作业上作强火剂
(4)、氧化物 的主要用途 碱土氧化物 氧化剂 漂白剂 供氧剂 引火剂 碱土金属的BeO,MgO具有很高的熔点 和硬度, 用于制耐火材料和金属陶 瓷。CaO俗称石灰或生石灰,作建筑 材料,也用做干燥剂,炼钢工业上用 于除去Si、P杂质。 过氧化物、超氧化物、臭氧化物都是 强氧化剂。 由于它们的强氧化性,可用于纸张、 织物等的漂白剂 利用它们与二氧化碳反应生成氧气的 性质作为潜水、登山、高空作业的供 氧剂 过氧化钡常用于爆破作业上作强火剂 △ CaO+SiO2====CaSiO3 △ 3CaO+P2O5==Ca3(PO4)2