
NaCI (g) AH Ei.Na(g) CI(g) △H5=一Ei Na(g)+CI(g) NaCl (g) AH, △H, △H △H3 Na+(g)+CI-(g) NaCl (s) △H1Na的第一电离能I1; △H2CI的电子亲合能E的相反数一E; △H3NaCl的晶格能U的相反数一U; △H4NaCl的升华热S; 而△Hs=一E;,所以通过I1,E,U和S可求出键能E;
H 1 Na 的第一电离能 I 1 ; H 2 Cl 的电子亲合能 E 的相反数 - E ; H 3 NaCl 的晶格能 U 的相反数 - U ; H 4 NaCl 的升华热 S ; 而 H 5 = - E i , 所以通过 I1 ,E ,U 和 S 可求出键能 Ei 。 NaCl ( g ) Na ( g ) + Cl ( g ) H = E i Na ( g ) + Cl ( g ) NaCl ( g ) Na+ ( g ) H1 H4 H2 Cl-( g ) H3 + NaCl ( s ) H5 = - E i

3影响离子键强度的因素 从离子键的实质是静电引力Fcq1q2/r2出发,影响F大 小的因素有:离子的电荷q和离子之间的距离r。 1°离子电荷数的影响 电荷高,离子键强。 NaCl +1—-1 MgO +2—-2 m.p. 801Co 2800C U 786.7kJmo-1 3916.2 kJ.mol-1 2°离子半径的影响 半径大,离子间距大,作用力小;相反,半径小,作用力大。 NaCI CI-半径小N NaII-半径大 m.p. 801Co 660C。 U 786.7 kJ.mol-1 686.2 kJ.mol-1
1°离子电荷数的影响 电荷高,离子键强。 NaCl + 1 —— - 1 MgO + 2 —— - 2 m. p. 801C 2800C U 786.7 kJ·mol-1 3916.2 kJ·mol-1 2°离子半径的影响 半径大,离子间距大,作用力小;相反,半径小,作用力大。 NaCl Cl- 半径小 NaI I- 半径大 m. p. 801C 660C U 786.7 kJ·mol-1 686.2 kJ·mol-1 3 影响离子键强度的因素 从离子键的实质是静电引力 F q1 q2 / r 2 出发,影响 F 大 小的因素有:离子的电荷q 和离子之间的距离r
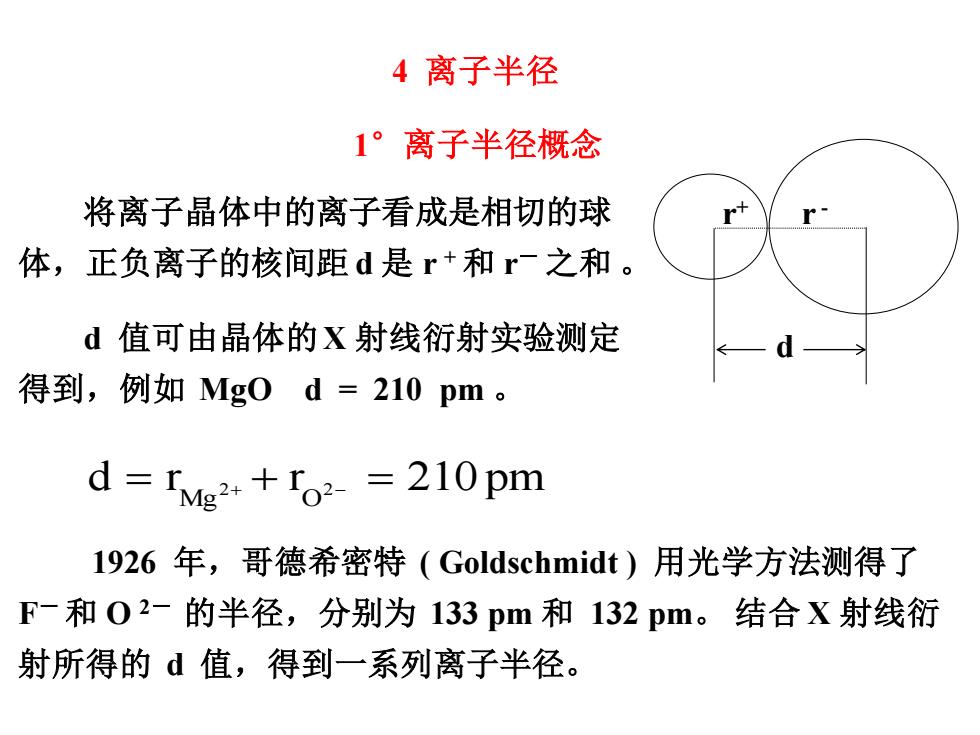
4离子半径 1°离子半径概念 将离子晶体中的离子看成是相切的球 体,正负离子的核间距d是r+和r-之和。 d值可由晶体的X射线衍射实验测定 得到,例如Mg0d=210pm。 d rMg2+o2-=210pm 1926年,哥德希密特(Goldschmidt)用光学方法测得了 F-和02-的半径,分别为133pm和132pm。结合X射线衍 射所得的d值,得到一系列离子半径
d 值可由晶体的X 射线衍射实验测定 得到,例如 MgO d = 210 pm 。 d = r Mg2+ + r O 2− = 210 pm 1926 年,哥德希密特 ( Goldschmidt ) 用光学方法测得了 F- 和 O 2- 的半径,分别为 133 pm 和 132 pm。 结合 X 射线衍 射所得的 d 值,得到一系列离子半径。 1°离子半径概念 将离子晶体中的离子看成是相切的球 体,正负离子的核间距 d 是 r + 和 r- 之和 。 d r + r - 4 离子半径

rMg2+=dMg0-'o2=210-132=78(pm) 这种半径为哥德希密特半径。 1927年,Pauling把最外层电子到核的距离,定义为离子半 径。并利用有效核电荷等数据,求出一套离子半径数值,被称为 Pauling半径。 教材上两套数据均列出。在比较半径大小和讨论变化规律时, 多采用Pauling半径。 2°离子半径的变化规律 a)同主族从上到下,电子层增加,具有相同电荷数的离子 半径增加。 Li+<Na+<K+<Rb+<Cs+F-<CI-<Br-<I b)同周期的主族元素,从左至右离子电荷数升高
1927 年,Pauling 把最外层电子到核的距离,定义为离子半 径。并利用有效核电荷等数据,求出一套离子半径数值,被称为 Pauling 半径 。 2°离子半径的变化规律 a ) 同主族从上到下,电子层增加,具有相同电荷数的离子 半径增加。 Li + < Na + < K + < Rb + < Cs + F- < Cl- < Br- < I- 教材上两套数据均列出。在比较半径大小和讨论变化规律时, 多采用 Pauling 半径 。 b ) 同周期的主族元素,从左至右离子电荷数升高, = d MgO- = 210 - 132 = 78 ( pm ) 这种半径为哥德希密特半径 。 r Mg2+ 2− O r

最高价离子半径减小。 Na+>Mg 2+>Al3+ K+>Ca2+ 过渡元素,离子半径变化规律不明显。 c)同一元素,不同价态的离子,电荷高的半径小。 如 Ti4+<Ti3+; Fe3+<Fe2+。 d)负离子半径一般较大;正离子半径一般较小。 第二周期 F 136pm; Li+60pm。 第四周期 Br-195 pm K+133pm。 虽然差了两个周期,F一仍比K+的半径大。 e)周期表中对角线上,左上的元素和右下的元素的离子半径 相近。 如 Li+和Mg2+;Sc3+和Zr4+半径相似
c ) 同一元素,不同价态的离子,电荷高的半径小。 如 Ti 4 + < Ti 3 + ; Fe 3 + < Fe 2 + 。 e ) 周期表中对角线上,左上的元素和右下的元素的离子半径 相近 。 如 Li + 和 Mg 2 + ; Sc 3 + 和 Zr 4 + 半径相似 。 d ) 负离子半径一般较大;正离子半径一般较小 。 第二周期 F- 136 pm ; Li + 60 pm 。 第四周期 Br- 195 pm ; K+ 133 pm 。 虽然差了两个周期, F- 仍比 K+ 的半径大 。 过渡元素,离子半径变化规律不明显 。 最高价离子半径减小。 Na + > Mg 2 + > Al 3 + K + > Ca 2 +