
三离子键的强度 1键能和晶格能 键能(以NaCI为例)1mol气态NaCI分子,离解成气 体原子时,所吸收的能量,用E:表示。 NaCI(g)=Na(g)+CI(g) △H=E: 键能E越大,表示离子键越强。 晶格能气态的正负离子,结合成1 mol NaC1晶体时,放 出的能量,用U表示。 Na(g)+CI(g)=NaCI(s) △H=一U 晶格能U越大,则形成离子键得到离子晶体时放出的能量 越多,离子键越强。 键能和晶格能,均能表示离子键的强度,而且大小关系一致。 晶格能比较常用
三 离子键的强度 1 键能和晶格能 键能 ( 以 NaCl 为例 ) 1 mol 气态 NaCl 分子,离解成气 体原子时,所吸收的能量,用 Ei 表示。 NaCl ( g ) = Na ( g ) + Cl ( g ) H = Ei 键能 Ei 越大,表示离子键越强。 晶格能 气态的正负离子,结合成 1 mol NaCl 晶体时,放 出的能量,用 U 表示。 Na + ( g ) + Cl- ( g ) = NaCl ( s ) H = -U 晶格能 U 越大,则形成离子键得到离子晶体时放出的能量 越多,离子键越强。 键能和晶格能,均能表示离子键的强度,而且大小关系一致。 晶格能比较常用
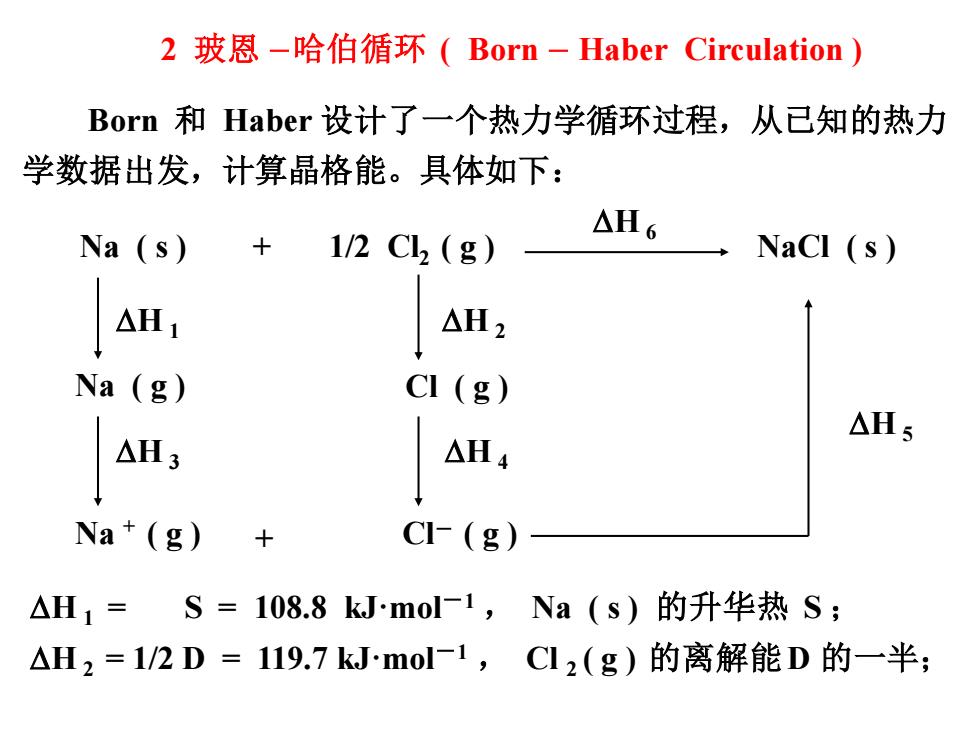
2玻恩-哈伯循环(Born-Haber Circulation) Borm和Haber设计了一个热力学循环过程,从已知的热力 学数据出发,计算晶格能。具体如下: △H6 Na (s) 1/2CL2(g) △H1 △H2 Na (g) CI (g) △H5 △H4 Na (g) CI-(g) △H1=S=108.8 kJmol-1,Na(s)的升华热S; △H2=1/2D=119.7 kJ.mol-1,Cl2(g)的离解能D的一半;
2 玻恩 -哈伯循环 ( Born - Haber Circulation ) Born 和 Haber 设计了一个热力学循环过程,从已知的热力 学数据出发,计算晶格能。具体如下: Na ( g ) H 1 Na + ( g ) H 3 Na ( s ) + 1/2 Cl2 ( g ) NaCl ( s ) H 6 H 1 = S = 108.8 kJ·mol-1 , Na ( s ) 的升华热 S ; H 2 = 1/2 D = 119.7 kJ·mol-1 , Cl 2 ( g ) 的离解能D 的一半; H 2 Cl ( g ) H 4 Cl- ( g ) H 5 +
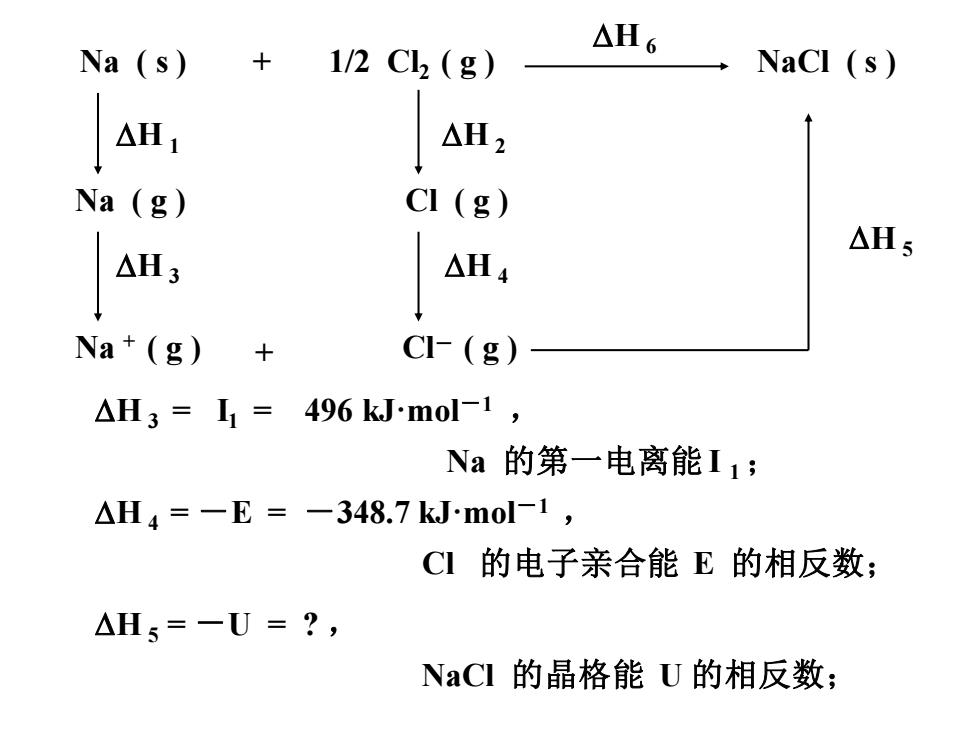
△H6 Na (s) 1/2C2(g) NaCI (s) △H1 △H2 Na (g) CI (g) △Hs △H3 △H4 Na (g) CI(g) △H3=I1=496 kJ.mol-1, Na的第一电离能I1; △H4=-E=-348.7 kJ.mol-1, CI的电子亲合能E的相反数; △Hs=一U=?, NaCI的晶格能U的相反数;
Na ( g ) H 1 Na + ( g ) H 3 Na ( s ) + 1/2 Cl2 ( g ) NaCl ( s ) H 6 H 2 Cl ( g ) H 4 Cl- ( g ) H 5 + H 3 = I1 = 496 kJ·mol-1 , Na 的第一电离能I 1 ; H 4 = -E = -348.7 kJ·mol-1 , Cl 的电子亲合能 E 的相反数; H 5 = -U = ? , NaCl 的晶格能 U 的相反数;
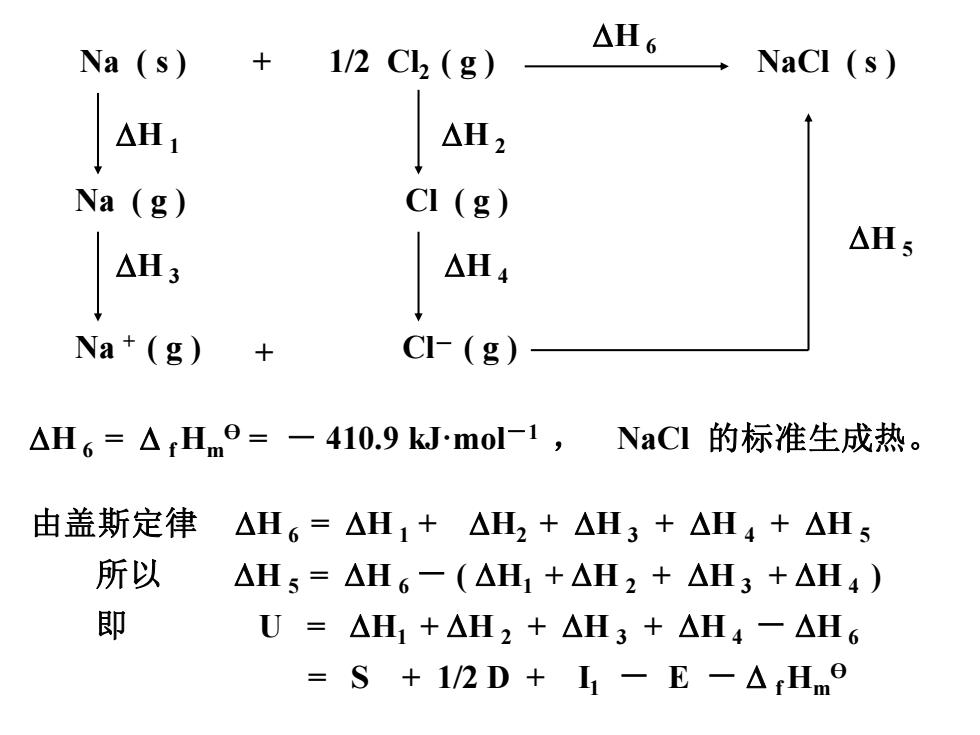
△H6 Na (s)+ 1/2C2(g) NaCl (s) △H1 △H2 Na(g) CI (g) △Hs AH, △H4 Na+(g) CI-(g) △H6=△rHm=一410.9kmol-1,NaCI的标准生成热。 由盖斯定律△H6=△H1+△H2+△H3+△H4+△Hs 所以 △Hs=△H6一(△H1+△H2+△H3+△H4) 即 U=△H1+△H2+△H3+△H4-△H6 =S+1/2D+1-E-△Hm9
Na ( g ) H 1 Na + ( g ) H 3 Na ( s ) + 1/2 Cl2 ( g ) NaCl ( s ) H 6 H 2 Cl ( g ) H 4 Cl- ( g ) H 5 + H 6 = f Hm Ө = - 410.9 kJ·mol-1 , NaCl 的标准生成热。 由盖斯定律 H 6 = H 1 + H2 + H 3 + H 4 + H 5 所以 H 5 = H 6 - ( H1 + H 2 + H 3 + H 4 ) 即 U = H1 + H 2 + H 3 + H 4 - H 6 = S + 1/2 D + I1 - E - f Hm Ө

U=108.8+119.7+496-348.7+410.9 =786.7(kJ-mol-1) 以上关系称为Borm一Haber循环。 利用盖斯定律,也可以计算NaCI的离子键的键能。 △H=Ei NaCl (g) Na (g) + C1(g) Na(g)+CI (g)- AHs=-Ei NaCI (g) AH, AH: △H3 Nat(g)+CI-(g) NaCl (s)
U = 108.8 + 119.7 + 496 - 348.7 + 410.9 = 786.7 ( kJ·mol-1 ) 以上关系称为 Born - Haber 循环 。 利用盖斯定律,也可以计算 NaCl 的离子键的键能。 NaCl ( g ) Na ( g ) + Cl ( g ) H = E i Na+ ( g ) H1 H4 H2 Cl-( g ) H3 + NaCl ( s ) Na ( g ) + Cl ( g ) NaCl ( g ) H5 = - E i