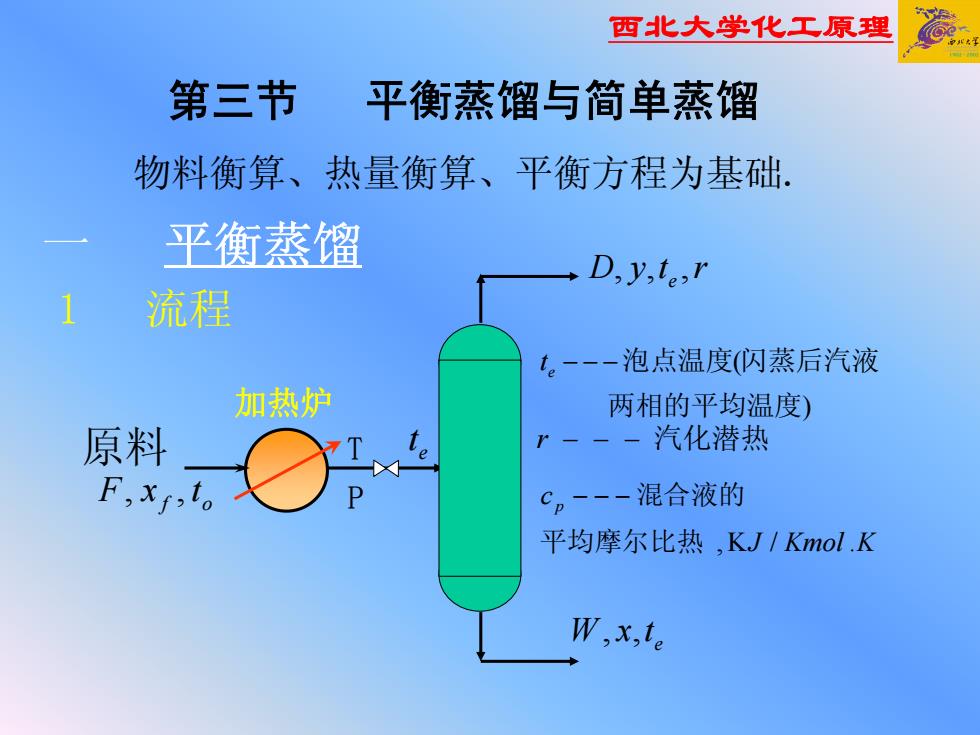
西北大学化工原理 物料衡算、热量衡算、平衡方程为基础. 一 平衡蒸馏 1 流程 第三节 平衡蒸馏与简单蒸馏 e , rtyD of , txF 原料 T P ) ( 两相的平均温度 te −−− 泡点温度 闪蒸后汽液 r − − − 汽化潜热 KKmolJ c p 平均摩尔比热 ./K, −−− 混合液的 et 加热炉 e , txW
西北大学化工原理 物料衡算、热量衡算、平衡方程为基础. 一 平衡蒸馏 1 流程 第三节 平衡蒸馏与简单蒸馏 e , rtyD of , txF 原料 T P ) ( 两相的平均温度 te −−− 泡点温度 闪蒸后汽液 r − − − 汽化潜热 KKmolJ c p 平均摩尔比热 ./K, −−− 混合液的 et 加热炉 e , txW

西北大学化工原理 设液相产物占总加料量的分率为 q,即, FqDq FW = = − )1(, ⎩⎨⎧ += += WxDyFx WDFf 总组分 轻组分 联立求解得 整理成y的表达式 q q f q xy xx F D xxy q f 1 1 1 1 − − − − −= −== 2 物料衡算 ⎩⎨⎧ += += WxDyFx WDFf q q f q xy xx F D xxy q f 1 1 1 1 − − − − −= −==
西北大学化工原理 设液相产物占总加料量的分率为 q,即, FqDq FW = = − )1(, ⎩⎨⎧ += += WxDyFx WDFf 总组分 轻组分 联立求解得 整理成y的表达式 q q f q xy xx F D xxy q f 1 1 1 1 − − − − −= −== 2 物料衡算 ⎩⎨⎧ += += WxDyFx WDFf q q f q xy xx F D xxy q f 1 1 1 1 − − − − −= −==

西北大学化工原理 加热炉的热流量 )( 0 = P −tTFcQ 节流减压后,物料放出显热供自身汽化,所以 p e eP c r qtT FrqDrtTFc )1( )1()( −+= − = = − 3 热量衡算
西北大学化工原理 加热炉的热流量 )( 0 = P −tTFcQ 节流减压后,物料放出显热供自身汽化,所以 p e eP c r qtT FrqDrtTFc )1( )1()( −+= − = = − 3 热量衡算

西北大学化工原理 即:两相温度相同,组成互成平衡,则: = xfy )( 对理想溶液 x x y −+ )1(1 = α α 平衡温度 与组成 e t x xft )( e 应满足泡点方程 = 4 特征方程: 平衡蒸馏中可假设汽,液两相处于平衡状态
西北大学化工原理 即:两相温度相同,组成互成平衡,则: = xfy )( 对理想溶液 x x y −+ )1(1 = α α 平衡温度 与组成 e t x xft )( e 应满足泡点方程 = 4 特征方程: 平衡蒸馏中可假设汽,液两相处于平衡状态
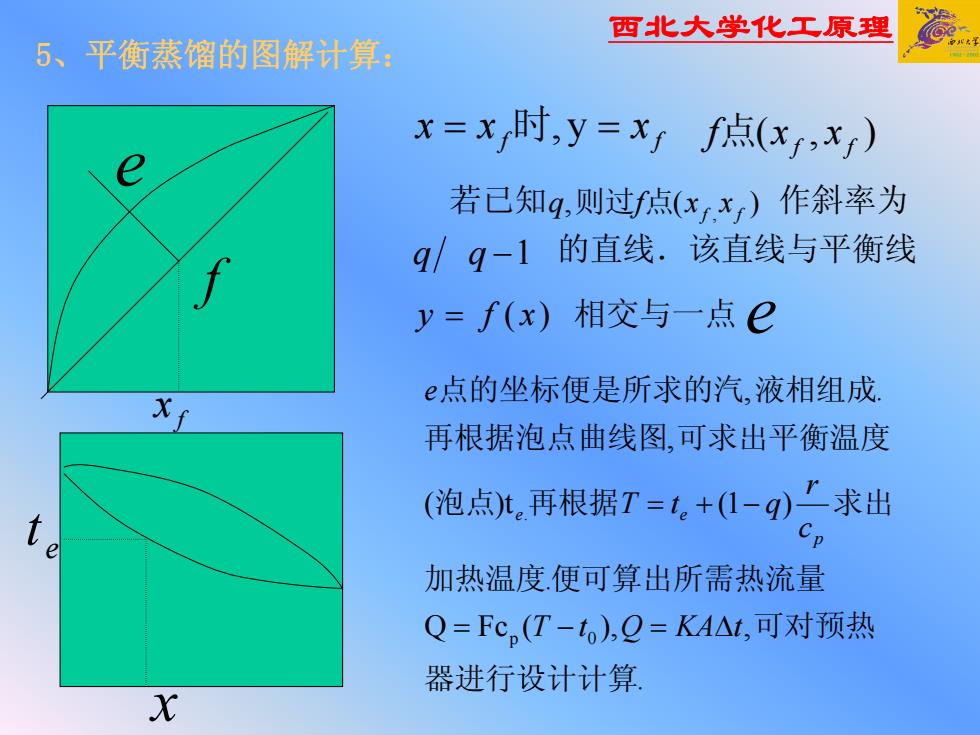
西北大学化工原理 f f = 时 y, = xxx ),( ff 点 xxf 若已知 作斜率为 qq −1 的直线.该直线与平衡线 = xfy )( 相交与一点 . ,),(FcQ . )t( )1( , ., 0p . 器进行设计计算 可对预热 加热温度便可算出所需热流量 泡点 再根据 求出 再根据泡点曲线图 可求出平衡温度 点的坐标便是所求的汽 液相组成 tKAQtT c r qtT e p e e Δ=−= −+= )(, , ff 则过 点 xxfq e t x f e f x e 5、平衡蒸馏的图解计算:
西北大学化工原理 f f = 时 y, = xxx ),( ff 点 xxf 若已知 作斜率为 qq −1 的直线.该直线与平衡线 = xfy )( 相交与一点 . ,),(FcQ . )t( )1( , ., 0p . 器进行设计计算 可对预热 加热温度便可算出所需热流量 泡点 再根据 求出 再根据泡点曲线图 可求出平衡温度 点的坐标便是所求的汽 液相组成 tKAQtT c r qtT e p e e Δ=−= −+= )(, , ff 则过 点 xxfq e t x f e f x e 5、平衡蒸馏的图解计算: