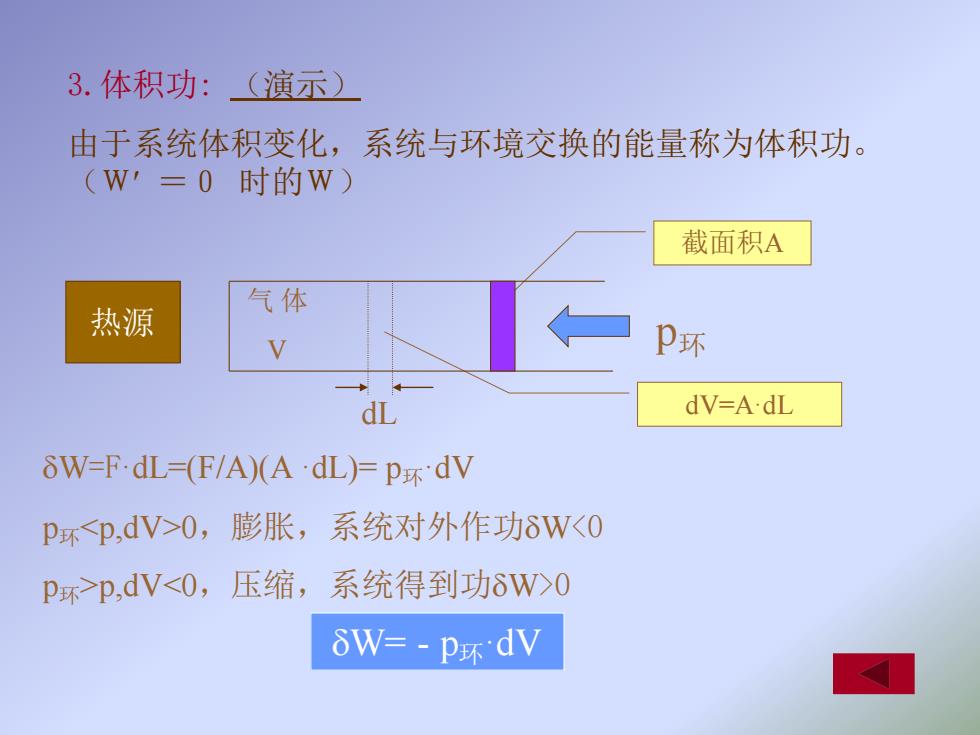
3.体积功:(演示) 由于系统体积变化,系统与环境交换的能量称为体积功。 (W'=0时的W) 截面积A 气体 热源 P环 dL dV=A.dL δW=FdL(F/A)(AdL)Fp环dV P环≤p,dV>O,膨胀,系统对外作功8W<0 p环>p,dV<O,压缩, 系统得到功δW>0 δW=-p怀dV
3.体积功: (演示) 由于系统体积变化,系统与环境交换的能量称为体积功。 (W =0 时的W) W=F·dL=(F/A)(A ·dL)= p环·dV p环<p,dV>0,膨胀,系统对外作功W<0 p环>p,dV<0,压缩,系统得到功W>0 W= - p环·dV 热源 dL dV=A·dL 截面积A p环 气 体 V

A 体积功
体积功

4.体积功计算 (条件W'=0) 微小功: W(体)=-p(环)dW 功: p(体)=an=-环dr V. 5.过程函数的特点 ①只有系统发生一个变化时才有过程函数。 ②过程函数不仅与始、终态有关,还与途径有关。 ③没有微分,只有微小量。微小量用δQ、8W表示
4.体积功计算 (条件W =0) 微小功: 功: 5.过程函数的特点 只有系统发生一个变化时才有过程函数。 过程函数不仅与始、终态有关,还与途径有关。 没有微分,只有微小量。微小量用Q、 W表示。 W p dV V V V V W = = − 2 1 2 1 (体) (环) W(体)=−p(环)dV

七、可逆体积功 1,可逆过程: 在一系列无限接近平衡条件下进的过程,称为可逆过程, 否则称为不可逆过程 2.可逆体积功计算[W'=0,Wr(体)=W] 微小功:w(体)=-pdW 功:W,(体)=-pdV 3,理想气体恒温可逆体积功计算: W=-nRTIn(V2/V)=-nRTIn(p1/p2) 适用条件:理想气体、W”=0、恒温、可逆过程
七、可逆体积功 1.可逆过程: 在一系列无限接近平衡条件下进的过程,称为可逆过程, 否则称为不可逆过程 2.可逆体积功计算[W =0,Wr(体)=W] 微小功: 功: 3.理想气体恒温可逆体积功计算: Wr =-nRTln(V2 /V1 )=-nRTln(p1 /p2 ) 适用条件:理想气体、 W =0、恒温、可逆过程 pdV Wr (体)=− pdV Wr V V = − 2 1 (体)

八、热力学能 The internal energy 系统的能量:宏观动能、势能和内能。 热力学研究中只关注热力学能,因此内能又称为热力学能 1:热力学能定义:系统内部所有粒子微观能量总和。 用U表示,单位为:J,kJ 2.热力学能组成: ①分子的动能一分子的热运动,是T的函数。 ②分子间相互作用势能一主要取决于分子间距离,是V、T的 函数。(对理想气体没有势能) ③分子内部的能量一 电子、原子核等的能量。 3.热力学能是状态函数,广延性质
八、热力学能 The internal energy 系统的能量: 宏观动能、势能和内能。 热力学研究中只关注热力学能,因此内能又称为热力学能 1.热力学能定义:系统内部所有粒子微观能量总和。 用U表示,单位为:J,kJ 2.热力学能组成: ①分子的动能——分子的热运动,是T的函数。 ②分子间相互作用势能——主要取决于分子间距离,是V、T的 函数。(对理想气体没有势能) ③分子内部的能量——电子、原子核等的能量。 3.热力学能是状态函数,广延性质