
3.2水溶液中的单相离子平衡 各晷晷光 1.酸碱的概念 0凡能给出质子的物质都是酸; 口凡能与质子结合的物质都是碱。 酸■H+十碱 20252/15 上页 下页 16
2025/2/15 16 3.2水溶液中的单相离子平衡 1.酸碱的概念 凡能给出质子的物质都是酸; 凡能与质子结合的物质都是碱。 酸 H+ + 碱
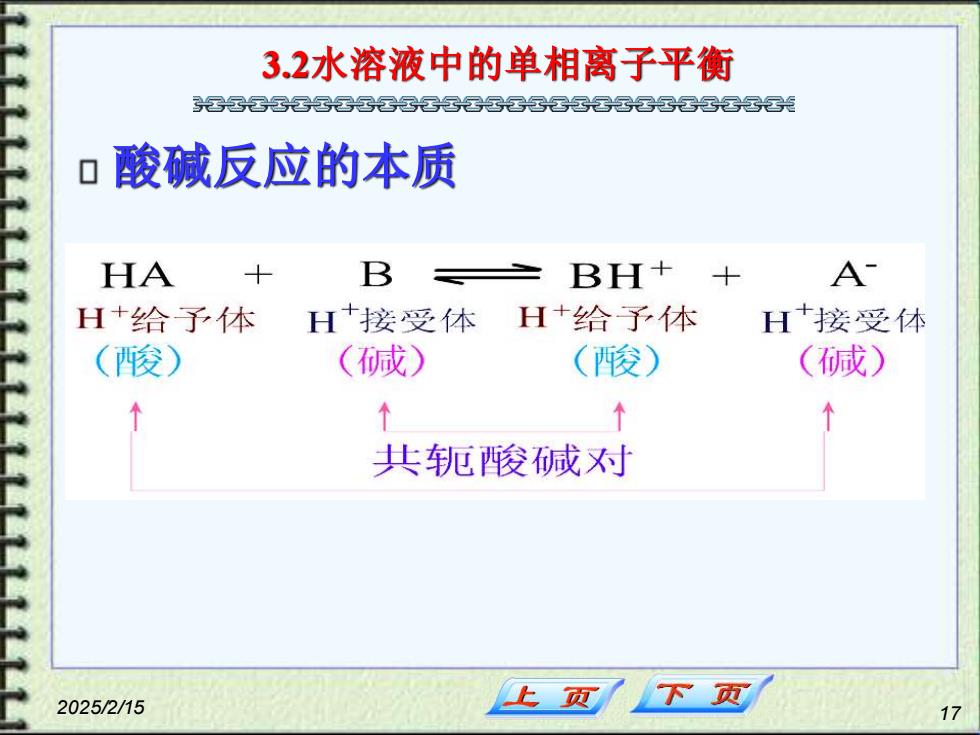
32水溶液中的单相离子平衡 军云晷云军军国云云光 口酸碱反应的本质 HA 十 B BH+ A H+给予体 H+接受体 H+给予体 H+接受体 (酸) (碱) (酸) (碱) ↑ 共轭酸碱对 2025/2/15 上页 下页 17
2025/2/15 17 3.2水溶液中的单相离子平衡 酸碱反应的本质

3.2水溶液中的单相离子平衡 各晷晷光 酸碱的相对强度 ☒无法显示该图片。 0 Ka:解离常数KacH,O)酸性 K,HA)-H,0)cAc) c (HA)t Ka Kb=Kw 2025/2/15 上页了下页 18
2025/2/15 18 3.2水溶液中的单相离子平衡 酸碱的相对强度 Ka:解离常数 Ka c(H3O+ )酸性 c c c c c c K eq eq eq a (HA)/ (H O )/ (A )/ (HA) 3 + − = KaKb=Kw

3.2水溶液中的单相离子平衡 军云晷云军军国云云光 2.酸和碱在水溶液中的离子平衡 及pH值的计算 ◇ (1)一元弱酸、碱的解离平衡 HA(ag)H(ag)+A(aq) 解离度a=(解离分子数)/(分子总数) K 0以 1 c9(H)=ca≈√K。c 2025/2/15 上页 下页 19
2025/2/15 19 3.2水溶液中的单相离子平衡 2.酸和碱在水溶液中的离子平衡 及pH值的计算 (1)一元弱酸、碱的解离平衡 HA(aq) H+ (aq) + A- (aq) c H ca K c a eq = + ( ) 解离度 a=(解离分子数)/(分子总数) = c Ka

3.2水溶液中的单相离子平衡 各晷晷光 (2)多元弱酸(碱)的分步解离 多元酸的Ka1>>Ka2。 0 当:≥500时 Kal c9(H+)≈VKaC 2025/2/15 上页 下页 20
2025/2/15 20 3.2水溶液中的单相离子平衡 (2)多元弱酸(碱)的分步解离 多元酸的 Ka1>>Ka2。 c H K c a eq + 1 ( ) 500 Ka1 c 当: 时