
3.1溶液的通性 兴兴兴 口3.渗透压:由渗透作用引起的溶剂与 溶液两边的压力差称为渗透压。 讀 纯溶剂 2025/2/15 上页 下页
2025/2/15 11 3.1 溶液的通性 3.渗透压Π :由渗透作用引起的溶剂与 溶液两边的压力差称为渗透压

Van'tHo范特霍去, πV=nRT π=cRT≈mRT π:渗透压;:溶液体积;R:气体常数;:溶 质物质的量;c:体积摩尔浓度; T:温度;R=8.314kPa·L·K-1-mot-I 结论:蒸气压下降,沸点上升,凝固点下 降,渗透压都是难挥发的非电解质稀溶液的 通性;它们只与溶剂的本性和溶液的浓度有 关,而与溶质的本性无关。 2025/2/15 页 下页 12
2025/2/15 12 Van’t Hoff (范特霍夫) :渗透压;V:溶液体积;R:气体常数; n:溶 质物质的量; c:体积摩尔浓度; T: 温度; R = 8.314 kPa ·L ·K-1 ·mol-1 V = nRT = cRT mRT 结论: 蒸气压下降,沸点上升,凝固点下 降,渗透压都是难挥发的非电解质稀溶液的 通性;它们只与溶剂的本性和溶液的浓度有 关,而与溶质的本性无关
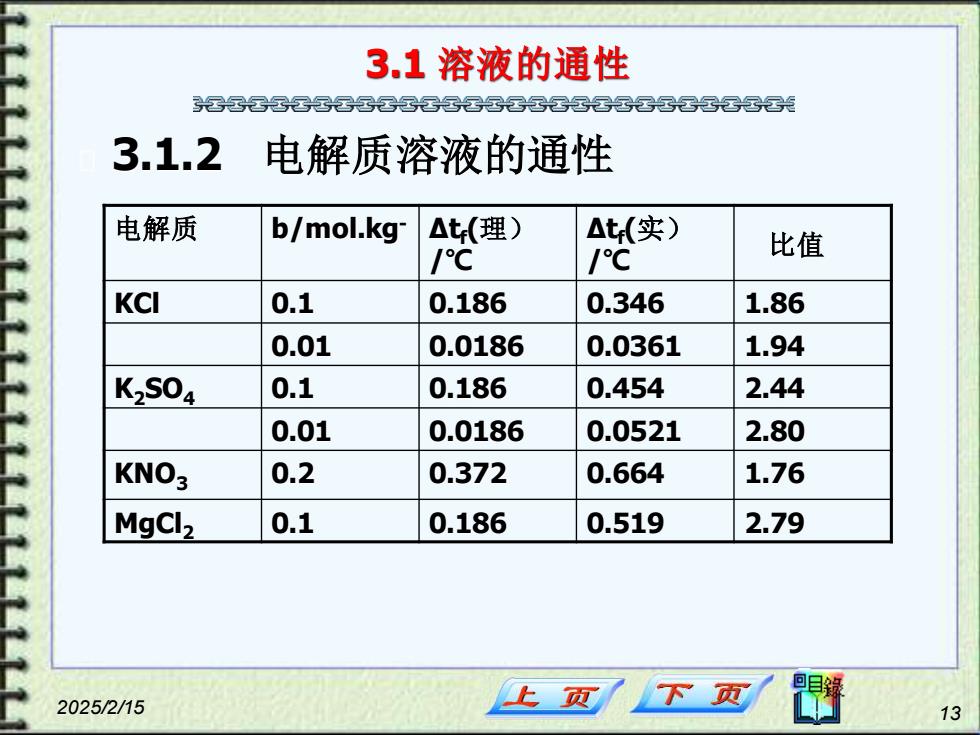
3.1溶液的通性 军云晷云军云军国云云光 3.1.2 电解质溶液的通性 电解质 b/mol.kg △t(理) △t(实) /℃ /℃ 比值 KCI 0.1 0.186 0.346 1.86 0.01 0.0186 0.0361 1.94 K2S04 0.1 0.186 0.454 2.44 0.01 0.0186 0.0521 2.80 KNO3 0.2 0.372 0.664 1.76 MgCl2 0.1 0.186 0.519 2.79 2025/2/15 上页 13
2025/2/15 13 3.1 溶液的通性 3.1.2 电解质溶液的通性 电解质 b/mol.kg- Δtf(理) /℃ Δtf(实) /℃ 比值 KCl 0.1 0.186 0.346 1.86 0.01 0.0186 0.0361 1.94 K2SO4 0.1 0.186 0.454 2.44 0.01 0.0186 0.0521 2.80 KNO3 0.2 0.372 0.664 1.76 MgCl2 0.1 0.186 0.519 2.79

3.2水溶液中的单相离子平衡 各晷晷光 口3.2水溶液中的单相离子平衡 3.2.1酸和碱在水溶液中的解离平衡 3.2.2配离子的解离平衡 20252/15 上页了下页 14
2025/2/15 14 3.2水溶液中的单相离子平衡 3.2 水溶液中的单相离子平衡 3.2.1 酸和碱在水溶液中的解离平衡 3.2.2 配离子的解离平衡

32水溶液中的单相离子平衡 军军云云云军晷宝军军云名国名名名名 3.2.1酸和碱在水溶液中的解离平衡 1.酸和碱的概念 2.酸和碱在水溶液中的离子平衡及pH 值的计算 3.缓冲溶液和pH的控制 2025/2/15 上页 下页 15
2025/2/15 15 3.2水溶液中的单相离子平衡 3.2.1 酸和碱在水溶液中的解离平衡 1.酸和碱的概念 2.酸和碱在水溶液中的离子平衡及pH 值的计算 3.缓冲溶液和pH的控制