
推广:在温度为T的平衡态下,分子的每一个转动自由度 上也具有相同的平均动能,大小也为kT2。 能量按自由度均分定理: 在温度为T的平衡态下,气体分子每个自由度 的平均动能都相等,都等于kT/2。这就是能量 按自由度均分定理,简称能量均分定理。 说明: 8 ·是统计规律,只适用于大量分 单原子分子=3εk=3kT2 子组成的系统。 双原子分子=5εk=5kT2 ·气体分子无规则碰撞的结果。 多原子分子=6εk=6kT12 统计物理可给出严格证明
能量按自由度均分定理: 说明: •是统计规律,只适用于大量分 子组成的系统。 • 气体分子无规则碰撞的结果。 •统计物理可给出严格证明。 推广:在温度为T 的平衡态下,分子的每一个转动自由度 上也具有相同的平均动能,大小也为kT/2。 在温度为T的平衡态下,气体分子每个自由度 的平均动能都相等,都等于kT/2。这就是能量 按自由度均分定理,简称能量均分定理。 单原子分子i=3 εk=3kT/2 双原子分子i=5 εk=5kT/2 多原子分子i=6 εk=6kT/2 kT i k 2 =
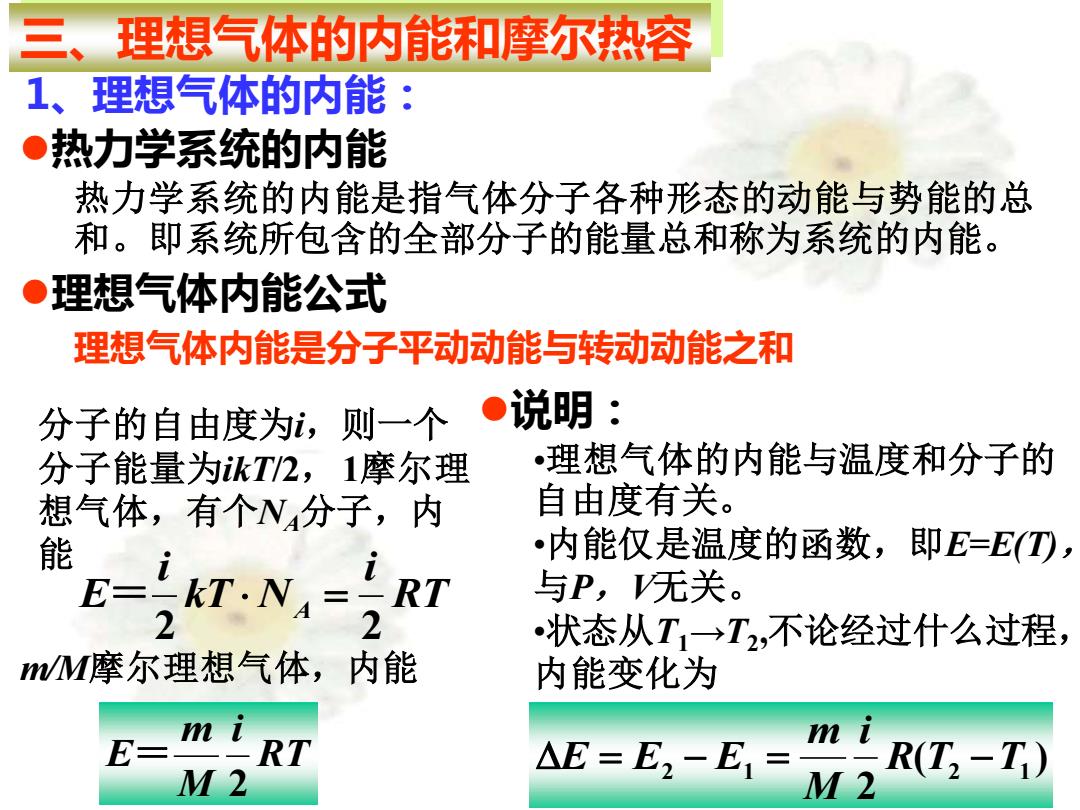
三、理想气体的内能和摩尔热容 1、理想气体的内能: ●热力学系统的内能 热力学系统的内能是指气体分子各种形态的动能与势能的总 和。即系统所包含的全部分子的能量总和称为系统的内能。 ●理想气体内能公式 理想气体内能是分子平动动能与转动动能之和 分子的自由度为,则一个 ●说明: 分子能量为kT2,1摩尔理 理想气体的内能与温度和分子的 想气体,有个N4分子,内 自由度有关。 E-AT: •内能仅是温度的函数,即E=E①, 与P,无关。 状态从T1→T2,不论经过什么过程, M摩尔理想气体,内能 内能变化为 E m I RT m I M2 AE=E2-E= R(T2-T1)
⚫热力学系统的内能 热力学系统的内能是指气体分子各种形态的动能与势能的总 和。即系统所包含的全部分子的能量总和称为系统的内能。 三、理想气体的内能和摩尔热容 1、理想气体的内能: ⚫理想气体内能公式 理想气体内能是分子平动动能与转动动能之和 分子的自由度为i,则一个 分子能量为ikT/2,1摩尔理 想气体,有个NA分子,内 能 RT i kT N i E A 2 2 = = m/M摩尔理想气体,内能 RT i M m E 2 = ⚫说明: •理想气体的内能与温度和分子的 自由度有关。 •内能仅是温度的函数,即E=E(T), 与P,V无关。 •状态从T1→T2 ,不论经过什么过程, 内能变化为 ( ) 2 2 1 R T2 T1 i M m E = E − E = −
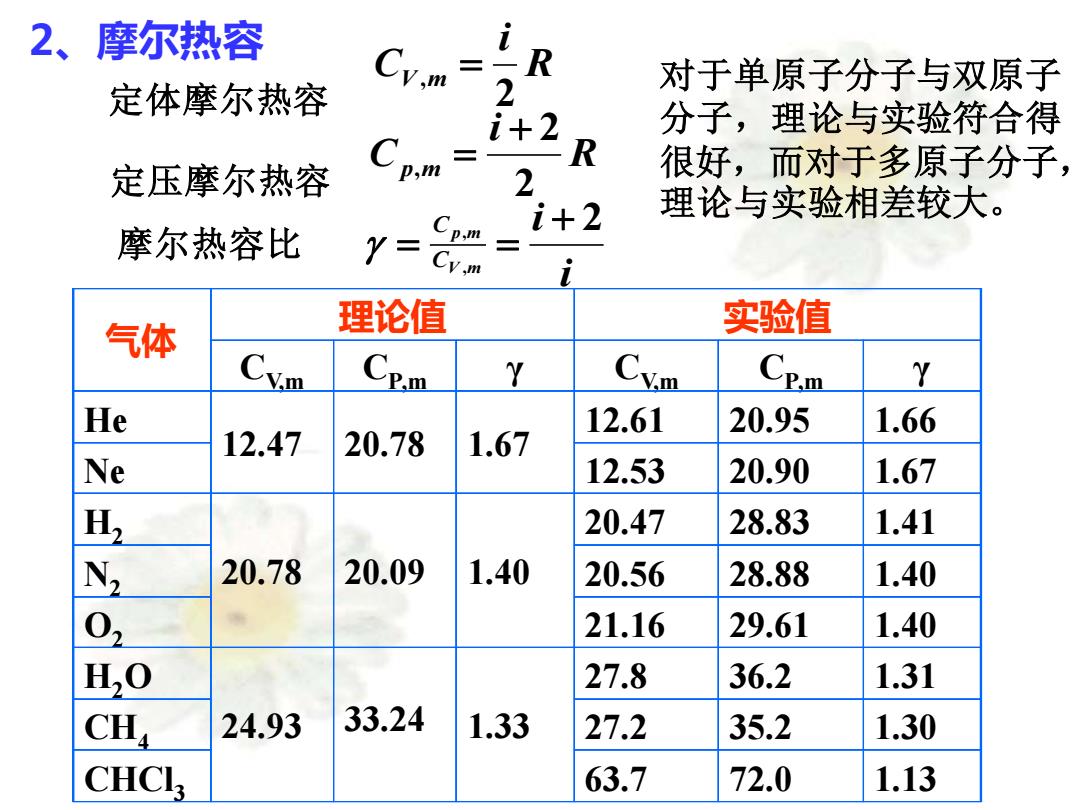
2、摩尔热容 R 对于单原子分子与双原子 定体摩尔热容 2 i+2 分子,理论与实验符合得 R 定压摩尔热容 p,m 很好,而对于多原子分子, 2 i+2 理论与实验相差较大。 摩尔热容比 Y= Cp.m 气体 理论值 实验值 Cy叫 Cem Cvm CE.m Y He 12.61 20.95 1.66 12.47 20.78 1.67 Ne 12.53 20.90 1.67 H, 20.47 28.83 1.41 N 20.78 20.09 1.40 20.56 28.88 1.40 02 21.16 29.61 1.40 H,O 27.8 36.2 1.31 CH 24.93 33.24 1.33 27.2 35.2 1.30 CHCI 63.7 72.0 1.13
2、摩尔热容 定体摩尔热容 R i CV m 2 , = 定压摩尔热容 R i Cp m 2 2 , + = 摩尔热容比 i i V m p m C C 2 , , + = = 气体 理论值 实验值 CV,m CP,m γ CV,m CP,m γ He 12.47 20.78 1.67 12.61 20.95 1.66 Ne 12.53 20.90 1.67 H2 20.78 20.09 1.40 20.47 28.83 1.41 N2 20.56 28.88 1.40 O2 21.16 29.61 1.40 H2O 24.93 33.24 1.33 27.8 36.2 1.31 CH4 27.2 35.2 1.30 CHCl3 63.7 72.0 1.13 对于单原子分子与双原子 分子,理论与实验符合得 很好,而对于多原子分子, 理论与实验相差较大

四、固体热容 设固体由N个原子组成,N个原子的三维振动,可以看成 是3N个一维振动。原子作一维振动时,自由度为2,一项 为动能,一项为势能。N个原子振动的平均能量为 E=3NE=3NkT 1mol晶体的内能为 E=3N kT=3RT 晶体的摩尔热容 do =3R dT dT =25.1J.mol-1.K-1
四、固体热容 设固体由N个原子组成,N个原子的三维振动,可以看成 是3N个一维振动。原子作一维振动时,自由度为i=2,一项 为动能,一项为势能。N个原子振动的平均能量为 E = 3N = 3NkT 1mol晶体的内能为 E = 3NA kT = 3RT 晶体的摩尔热容 1 1 25.1 3 − − = = = = J mol K R dT dE dT dQ Cm

7·5麦克斯韦气体速率分布律 引言: 气体分子处于无规则的热运动之中,由于碰撞,每个分 子的速度都在不断地改变,所以在某一时刻,对某个分 子来说,其速度的大小和方向完全是偶然的。然而就大 量分子整体而言,在一定条件下,分子的速率分布遵守 一 定的统计规律— 气体速率分布律。 气体分子按速率分布的统计规律最早是有麦克斯韦于1859年 在概率论的基础上导出的,1877年玻耳兹曼由经典统计力学 中导出,1920年斯特恩从实验中证实了麦克斯韦分子按速率 分布的统计规律
7-5 麦克斯韦气体速率分布律 引言: 气体分子处于无规则的热运动之中,由于碰撞,每个分 子的速度都在不断地改变,所以在某一时刻,对某个分 子来说,其速度的大小和方向完全是偶然的。然而就大 量分子整体而言,在一定条件下,分子的速率分布遵守 一定的统计规律——气体速率分布律。 气体分子按速率分布的统计规律最早是有麦克斯韦于1859年 在概率论的基础上导出的,1877年玻耳兹曼由经典统计力学 中导出,1920年斯特恩从实验中证实了麦克斯韦分子按速率 分布的统计规律