
4.1.2 标准平衡常数表达式 对于气相反应: H2(g)+I2(g)=2HΠ(g) [p(HⅡ)/pe]2 K8= [p(H2)/pe][p(I2)/pe] 对于溶液中的反应: 无机化学电子款 Sn2(aq)+2Fe3+(aq)-Sn++(aq)+2Fe2*(aq) ko_[c(Sn)/ce le(Fe2+)/ [c(Sn2+)/c ][c(Fe3+)/c ]2
4.1.2 标准平衡常数表达式 对于溶液中的反应: H (g) I (g) 2HI(g) 2 + 2 对于气相反应: [ (H )/ ][ (I )/ ] [ (HI)/ ] 2 2 2 p p p p p p K = Sn2+(aq)+2Fe3+(aq) Sn4+ (aq)+2Fe2+(aq) 2 3 2 4 2 2 [ (Sn ) ][ (Fe ) ] [ (Sn ) ][ (Fe ) ] c /c c /c c /c c /c + + + + K =

对于一般的化学反应: aA(g)+bB(aq)+cC(s)xX(g)+yY(aq)+zZ(1) ko-lp(x)poRlc(Y)/cop Ip(A)/pe]alc(B)1c] 无机化学电子 *K是量纲一的量。 *K是温度的函数,与浓度、分压无关。 *标准平衡常数表达式必须与化学反应计 量式相对应。 察
对于一般的化学反应: aA(g) + bB(aq) + cC(s) xX(g) + yY(aq) + zZ(l) K ( ) ( ) ( ) ( ) b c c a p p y c c x p p A / B / X / Y / = K 是温度的函数,与浓度、分压无关。 * 标准平衡常数表达式必须与化学反应计 量式相对应。 K 是量纲一的量
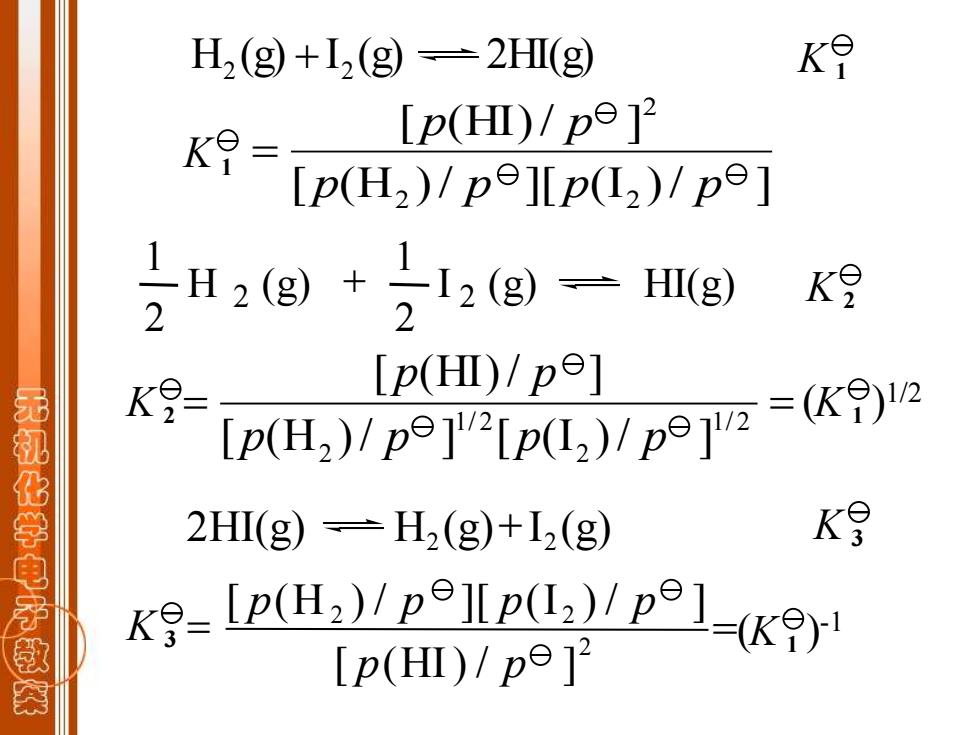
H2(g)+I2(g=2HΠ(g KO [p(H)/pe12 [p(H2)/pe][p(L2)/pe] H2g)+12(g)一Hmg) 2 2 K9 K9= [P(HI)/pe] 无机化学电子款 p(H)p() 2H(g)=H2(g)+I2(g) K月 -I()/p)p]- [p(H)/pe]2
H (g) I (g) 2HI(g) 2 + 2 K 1 [ (H )/ ][ (I )/ ] [ (HI)/ ] 2 2 2 p p p p p p K 1 = 2 I 2 (g) HI(g) 2 1 H (g) 2 1 + K 2 K 2 K 1 ( )1/2 = = 1/ 2 2 1/ 2 2 [ (H )/ ] [ (I )/ ] [ (HI)/ ] p p p p p p 2HI(g) H2 (g)+ I2 (g) K 3 =( ) K 1 K -1 3 [ (H ) / ][ (I ) / ] [ (HI) / ] 2 2 2 p p p p p p =

多重平衡原理 例题:已知25℃时反应 ①2BrCI(g)=CL2(g+Br2(g)的K9=0.45 ②L2(g+Br2(g)一2IBr(g)的K8=0.051 计算反应 ③2BrCI(g)+I2(g)=2IBr(g+C12(g)的K号。 无机化学电子教菜 解:反应①+②得: 2BrCI(g)+12(g)=2IBr(g)+Cl2(g) K号=K9.K9=0.45×0.051=0.023
例题:已知25℃时反应 多重平衡原理 解:反应① + ②得: K 3 = K 1 ·K 2 = 0.45×0.051=0.023 ③2BrCl (g)+ I2 (g) 2IBr(g)+ Cl2 (g)的 K 3 。 ②I2 (g)+Br2 (g) 2IBr(g)的 K 2 =0.051 计算反应 ①2BrCl(g) Cl2 (g)+Br2 (g)的 K 1 =0.45 2BrCl (g)+ I2 (g) 2IBr(g)+ Cl2 (g)

4.1.3 标准平衡常数的实验测定 例题:定温定容下,GeO(g)与W2O6(g)反 应生成GeWO4(g): 2GeO(g)+W2O6(g)=2 GeWOa(g) 无机化学电 若反应开始时,GeO和W,O。的分压均 为100.0kPa,平衡时GeWO4(g)的分压为 98.0kPa。求平衡时GeO和W,O6的分压以及 数 反应的标准平衡常数
例题:定温定容下,GeO(g)与W2O6 (g) 反 应生成GeWO4 (g) : 4.1.3 标准平衡常数的实验测定 若反应开始时,GeO和W2O6 的分压均 为100.0kPa,平衡时GeWO4 (g) 的分压为 98.0kPa。求平衡时GeO和W2O6的分压以及 反应的标准平衡常数。 2GeO (g) +W2O6 (g) 2 GeWO4 (g)