
3.1.1化学和物理变化过程中的热效应 (1)热效应(heat effect) 气体 指各类过程中放出 或吸收的热量,研究纯 沉积热 物质化学和物理变化过 升华热 蒸发热 程中热效应的学科叫热 熔化热 化学。 固体 液体 结晶热 (2) 能量守恒定律the law of conservation of energy 2得+2失=0 任何形式的能都不能凭空产生也不能凭空消 失,宇宙(环境+体系)的能量是恒定的。 上页 下页 目录 返回
Q得 + Q失 = 0 (2) 能量守恒定律(the law of conservation of energy) 任何形式的能都不能凭空产生也不能凭空消 失,宇宙(环境 + 体系)的能量是恒定的。 3.1.1 化学和物理变化过程中的热效应 指各类过程中放出 或吸收的热量,研究纯 物质化学和物理变化过 程中热效应的学科叫热 化学。 (1)热效应(heat ef ect)

(3)热容(heat capacit,c) 使某物体温度升高1K时所需的热量。热容除以 物质的量得摩尔热容(Molar heat capacity)Cm 2=nCm△T 物质 比热容(J/℃g) H0(0 4.18 100.0J的热量可使1mol H20(⊙) 2.03 Al(s) 0.89 铁的温度上升3.98K,求铁的 Fe(s) 0.45 Cmo Hg(1) 0.14 C(s) 0.71 Solution 100.0J Cm= 25.1 J.mol-1.K-1 RAT (1mol)3.98K 上页 下页 目录 返回
Q = nCm T (3) 热容(heat capacity, c) 使某物体温度升高1K时所需的热量。热容除以 物质的量得摩尔热容 (Molar heat capacity) Cm 100.0 J 的热量可使 1mol 铁的温度上升 3.98 K,求铁的 Cm。 1 1 m 25 1 J mol K 1mol 3 98K 100 0J . ( )( . ) . n T Q C 物质 比热容 (J/℃·g) H2O (l) 4.18 H2O (s) 2.03 Al (s) 0.89 Fe (s) 0.45 Hg (l) 0.14 C (s) 0.71 Solution
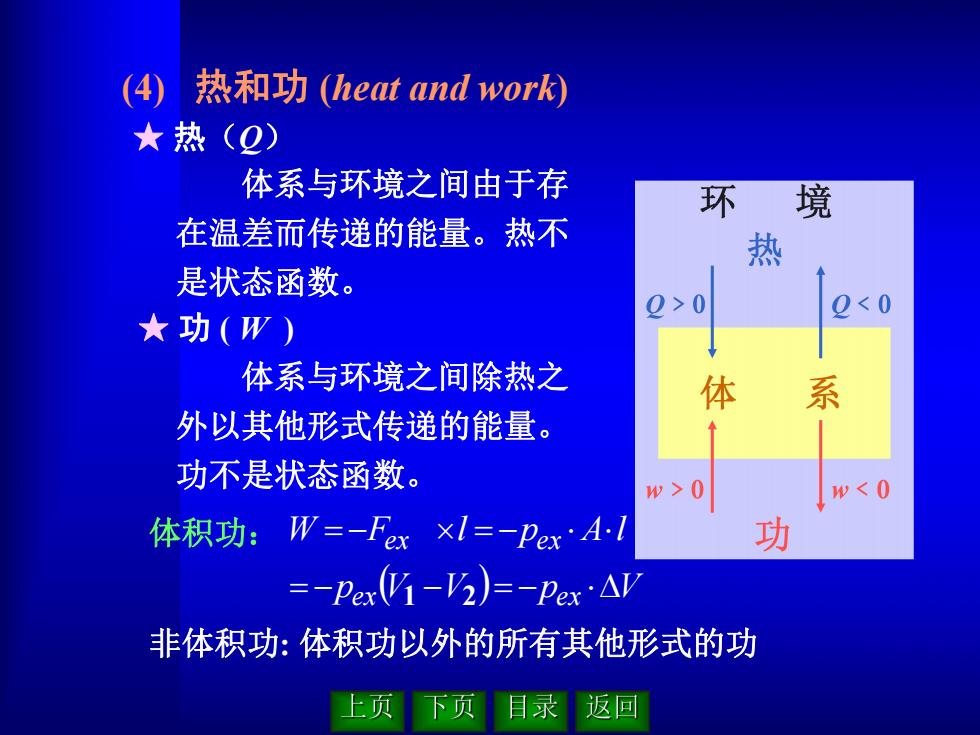
(4)热和功(heat and work) ★热(Q) 体系与环境之间由于存 环 境 在温差而传递的能量。热不 热 是状态函数。 0>0 )<0 ★功(W) 体系与环境之间除热之 体 系 外以其他形式传递的能量。 1 功不是状态函数。 w>0 w<0 体积功:W=-Fex×l=-Pex'Al 功 =-Pex(V1-V2)=-Pex.AV 非体积功:体积功以外的所有其他形式的功 上页 下页 目录 返回
体系与环境之间由于存 在温差而传递的能量。热不 是状态函数。 ★ 热(Q) (4) 热和功 (heat and work) 体系与环境之间除热之 外以其他形式传递的能量。 功不是状态函数。 p V V p V W F l p A l ex ex ex ex 1 2 非体积功: 体积功以外的所有其他形式的功 ★ 功 ( W ) 体积功:

(5) 热力学能(thermodynamic energy 大热力学能(U 体系内所有微观粒子的全部能量之和,U是状态函 数,热力学能变化只与始态、终态有关,与变化途 径无关。至今尚无法直接测定,只能测定到△U。 U2-U1=△U ★热力学第一定律 热力学第一定律的实质是能量守恒与转化定律 吸热0→U2 对于封闭体系热 得功W 力学第一定律为: U,=U+0+W U,-U=0+W △U=Q+W 上页 下页 目录返回
★热力学能 (U) 体系内所有微观粒子的全部能量之和,U是状态函 数,热力学能变化只与始态、终态有关,与变化途 径无关。至今尚无法直接测定,只能测定到 U。 U2 U1 U (5) 热力学能 (thermodynamic energy) U Q W 对于封闭体系热 力学第一定律为: U2 U1 Q W U2 U1 Q W U1 U2 得 吸功 热W Q ★ 热力学第一定律 热力学第一定律的实质是能量守恒与转化定律

Quest P 2 298K时,水的蒸发热为43.93 kJ-mol-1。计算蒸发1mol水时的2p, W和△U。 Solution H2O(1)=H2O(g), △rin=43.93kJmo1 2△,H9n43.3 kJ.mol-1 1mol水蒸发过程做的体积功为: W=p△V=△nRT=1×8.31410-3 kJ.mol-1K1×298K =2.48 kJmol-1 AU=O-W=43.93 kJ.mol-1-2.48 kJ-mol-1 41.45 kJ.mol-1 上页 下页 目录 返回
298 K时, 水的蒸发热为 43.93 kJ·mol -1 。计算蒸发1 mol水时的Qp, W 和 ΔU。 1 mol 水蒸发过程做的体积功为: W= pΔV= ΔnRT=1×8.314 10 -3 kJ·mol -1 ·K-1 × 298K = 2.48 kJ·mol -1 ΔU = Q –W = 43.93 kJ·mol -1 – 2.48 kJ·mol -1 = 41.45 kJ·mol -1 Question 2 Solution H2O(l) = H2O(g), = 43.93 kJ·mol θ –1 rHm Qp = = 43.93 kJ·mol θ –1 rHm