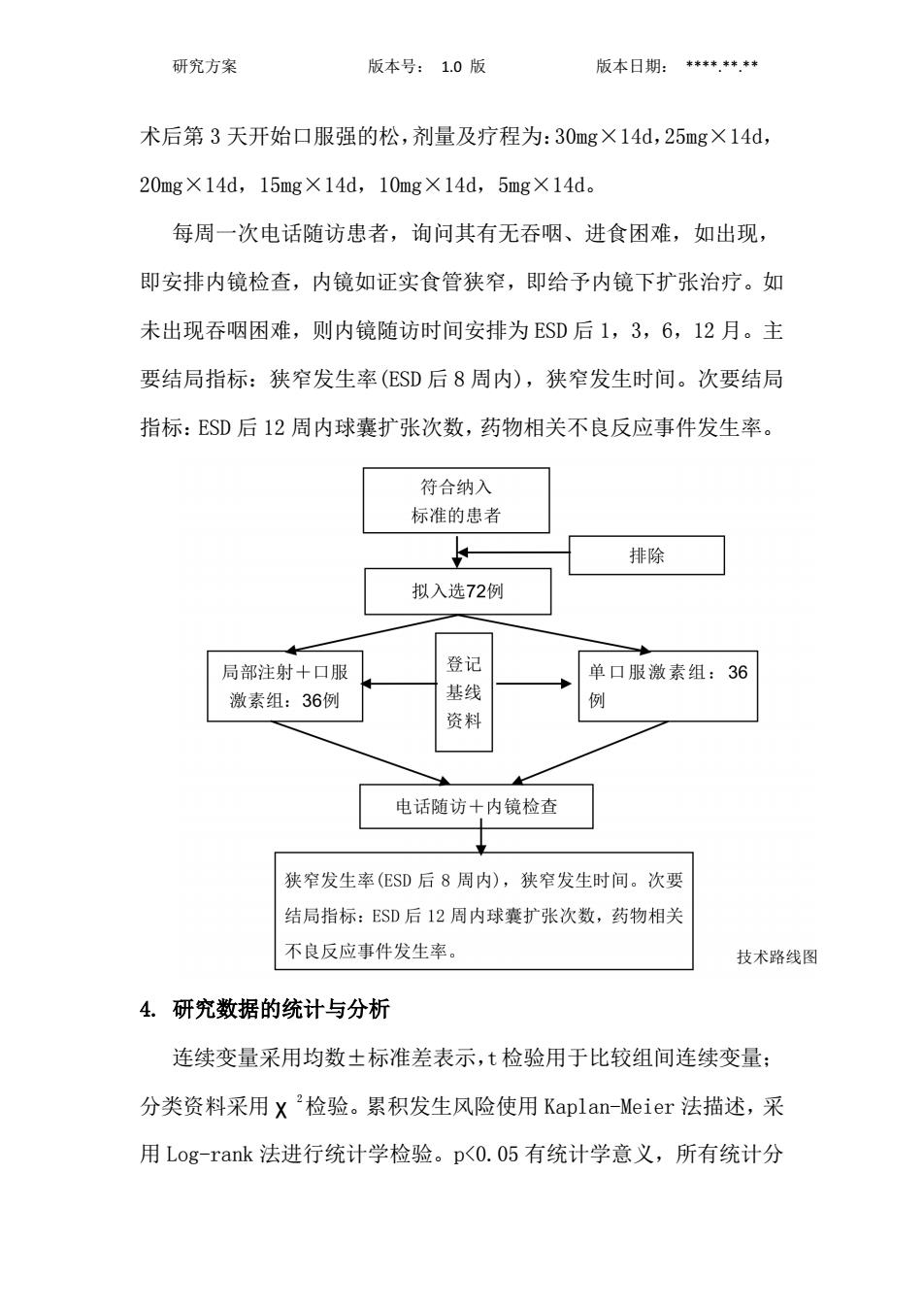
研究方案 版本号:1.0版 版本日期:+.*”.*中 术后第3天开始口服强的松,剂量及疗程为:30mg×14d,25mg×14d, 20mg×14d,15mg×14d,10mg×14d,5mg×14d。 每周一次电话随访患者,询问其有无吞咽、进食困难,如出现, 即安排内镜检查,内镜如证实食管狭窄,即给予内镜下扩张治疗。如 未出现吞咽困难,则内镜随访时间安排为ESD后1,3,6,12月。主 要结局指标:狭窄发生率(ESD后8周内),狭窄发生时间。次要结局 指标:SD后12周内球囊扩张次数,药物相关不良反应事件发生率。 符合纳入 标准的患者 排除 拟入选72例 局部注射+口服 登记 单口服激素组:36 激素组:36例 基线 例 资料 电话随访+内镜检查 狭窄发生率(ESD后8周内),狭窄发生时间。次要 结局指标:SD后12周内球囊扩张次数,药物相关 不良反应事件发生率。 技术路线图 4.研究数据的统计与分析 连续变量采用均数士标准差表示,t检验用于比较组间连续变量: 分类资料采用X2检验。累积发生风险使用Kaplan-Meier法描述,采 用Log-rank法进行统计学检验。p<0.05有统计学意义,所有统计分
研究方案 版本号: 1.0 版 版本日期: ****.**.** 术后第 3 天开始口服强的松,剂量及疗程为:30mg×14d,25mg×14d, 20mg×14d,15mg×14d,10mg×14d,5mg×14d。 每周一次电话随访患者,询问其有无吞咽、进食困难,如出现, 即安排内镜检查,内镜如证实食管狭窄,即给予内镜下扩张治疗。如 未出现吞咽困难,则内镜随访时间安排为 ESD 后 1,3,6,12 月。主 要结局指标:狭窄发生率(ESD 后 8 周内),狭窄发生时间。次要结局 指标:ESD 后 12 周内球囊扩张次数,药物相关不良反应事件发生率。 4. 研究数据的统计与分析 连续变量采用均数±标准差表示,t 检验用于比较组间连续变量; 分类资料采用 χ 2检验。累积发生风险使用 Kaplan-Meier 法描述,采 用 Log-rank 法进行统计学检验。p<0.05 有统计学意义,所有统计分

研究方案 版本号:1.0版 版本日期:*中.*.+ 析由SSS软件完成。对于最终未按照随机化分组结果接受改组治疗 方式的患者,及失访和脱落病例,在所有病例资料收集完成后,进行 PP分析和ITT分析。 5.质量控制 5.1医疗器械质量控制:研究所使用的仪器设备严格按照医院医疗器 械质量控制管理条例进行,定期对医疗器械进行安全检查,保证医疗 器械的正常运行:定期对医疗器械进行消毒、灭菌处理,避免交叉感 染。 5.2试验操作质量控制:试验前明确试验的纳入和排除标准,进行知 情同意。每个病人的ESD手术均由经验丰富的内镜专家完成,严格按 照操作规范进行,尽量避免出血、穿孔等并发症的发生。局部注射激 素由ESD术者亲自完成,由专人指导随访患者的口服激素情况,确保 患者激素服用的依从性,保证试验的真实性和准确性。 5.3试验数据质量控制:严格按照真实情况和规范进行试验数据的测 量、记录、签名和原始数据的存档:确定专人负责定期审核数据的真 实性。 6.研究相关伦理学 6.1伦理委员会审核:本方案和书面知情同意书及与受试者直接相关 的资料提交伦理委员会,获得伦理委员会书面批准后正式开展研究。 6.2书面知情同意:研究者必须向受试者或其法定代理人提供易于理 解的并且经伦理委员会批准的知情同意书,并给与受试者或其法定代 理人充分的时间考虑本项研究,在从受试者获得签署的书面知情同意
研究方案 版本号: 1.0 版 版本日期: ****.**.** 析由 SPSS 软件完成。对于最终未按照随机化分组结果接受改组治疗 方式的患者,及失访和脱落病例,在所有病例资料收集完成后,进行 PP 分析和 ITT 分析。 5. 质量控制 5.1 医疗器械质量控制:研究所使用的仪器设备严格按照医院医疗器 械质量控制管理条例进行,定期对医疗器械进行安全检查,保证医疗 器械的正常运行;定期对医疗器械进行消毒、灭菌处理,避免交叉感 染。 5.2 试验操作质量控制:试验前明确试验的纳入和排除标准,进行知 情同意。每个病人的 ESD 手术均由经验丰富的内镜专家完成,严格按 照操作规范进行,尽量避免出血、穿孔等并发症的发生。局部注射激 素由 ESD 术者亲自完成,由专人指导随访患者的口服激素情况,确保 患者激素服用的依从性,保证试验的真实性和准确性。 5.3 试验数据质量控制:严格按照真实情况和规范进行试验数据的测 量、记录、签名和原始数据的存档;确定专人负责定期审核数据的真 实性。 6. 研究相关伦理学 6.1 伦理委员会审核:本方案和书面知情同意书及与受试者直接相关 的资料提交伦理委员会,获得伦理委员会书面批准后正式开展研究。 6.2 书面知情同意:研究者必须向受试者或其法定代理人提供易于理 解的并且经伦理委员会批准的知情同意书,并给与受试者或其法定代 理人充分的时间考虑本项研究,在从受试者获得签署的书面知情同意